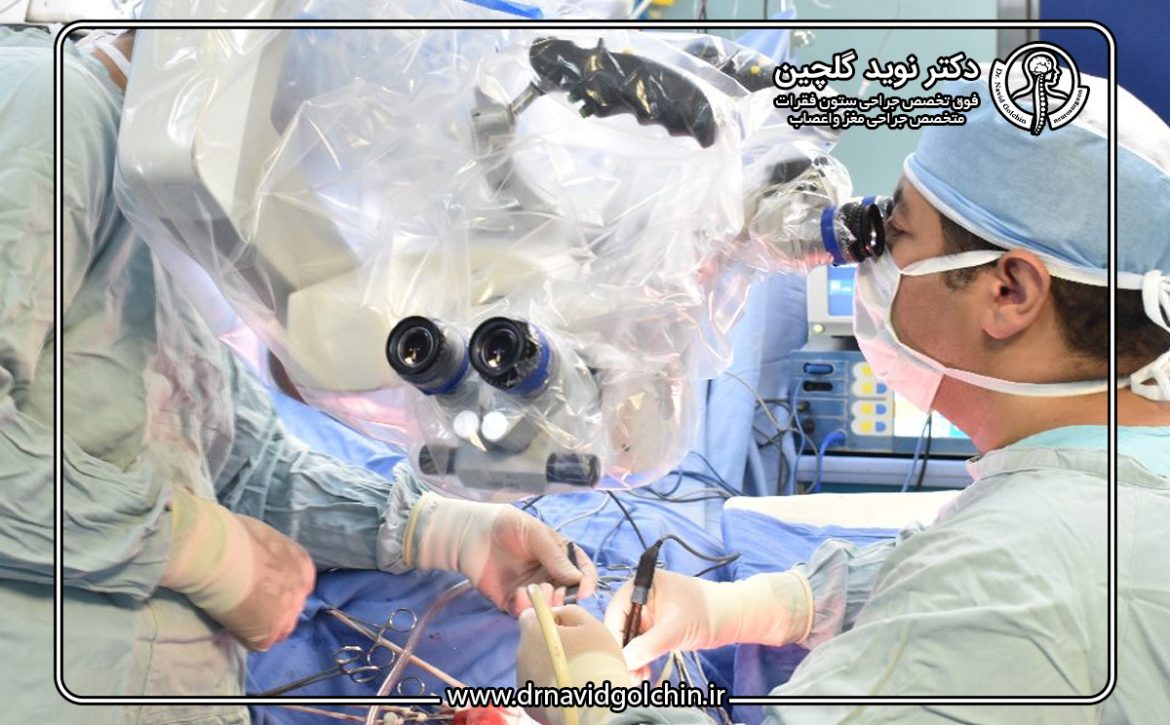
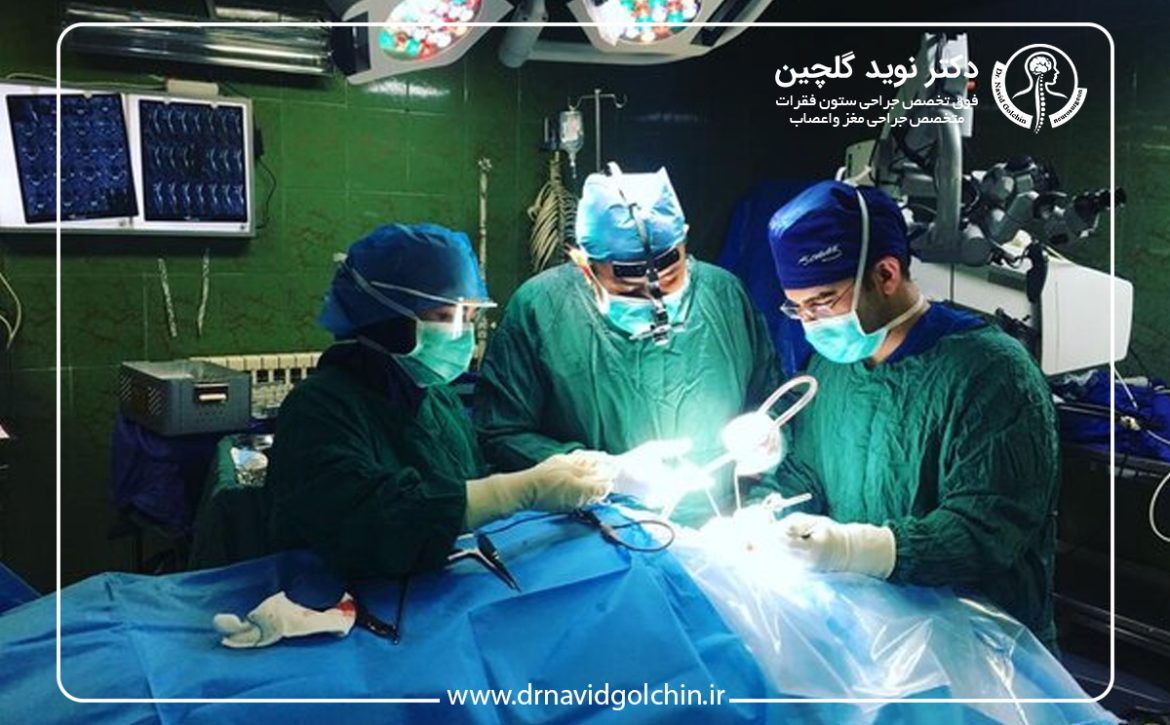
آیا جراحی آندوسکوپی بهترین روش درمان تومور هیپوفیز است؟
مقدمه
جراحی هیپوفیز یکی از روشهای اصلی درمان تومورهای هیپوفیز است، که این تومورها به عنوان یکی از شایعترین نئوپلاسمهای داخل جمجمه شناخته میشوند. با اینکه اغلب موارد خوشخیم هستند، این تومورها میتوانند تأثیرات بالینی قابلتوجهی بر عملکرد هورمونی، بینایی و کیفیت زندگی بیماران داشته باشند. تصمیمگیری درباره بهترین روش درمان، به ویژه زمانی که گزینههای مختلفی شامل درمان دارویی، جراحی باز، جراحی میکروسکوپیک و جراحی آندوسکوپی در دسترس هستند، به یکی از چالشهای مهم در حوزه نوروسرجری و اندوکرینولوژی تبدیل شده است.در دهههای اخیر، جراحی آندوسکوپی ترانساسفنوئیدال بهعنوان یک رویکرد کمتهاجمی، توجه گستردهای را به خود جلب کرده و در بسیاری از مراکز پیشرفته بهعنوان روش خط اول درمان تومورهای هیپوفیز مورد استفاده قرار میگیرد. با این حال، سؤال اساسی این است که آیا این روش را میتوان در همه بیماران، بهترین گزینه درمانی دانست یا انتخاب آن باید بر اساس فاکتورهای بالینی، آناتومیک و پاتولوژیک انجام شود.
اهمیت تصمیمگیری درمانی در تومورهای هیپوفیز
درمان تومور هیپوفیز صرفاً به برداشت توده محدود نمیشود، بلکه هدف اصلی، دستیابی به تعادل میان کنترل تومور، حفظ عملکرد هیپوفیز، کاهش عوارض جراحی و بهبود علائم بالینی بیمار است. هر تصمیم درمانی نادرست میتواند منجر به عوارض بلندمدت مانند هیپوپیتویتاریسم، اختلالات بینایی یا نیاز به مداخلات درمانی مجدد شود. از اینرو، انتخاب روش درمان باید مبتنی بر شواهد علمی، نتایج بالینی و تحلیل ریسک–فایده باشد.
جراحی آندوسکوپی بهعنوان یک گزینه Decision-based
جراحی آندوسکوپی هیپوفیز تنها یک تکنیک جراحی نیست، بلکه بخشی از یک فرآیند تصمیمگیری چندبعدی است که در آن عوامل متعددی نقش دارند. اندازه تومور، نوع عملکرد هورمونی، میزان تهاجم به ساختارهای اطراف مانند سینوس کاورنوز، وضعیت بینایی بیمار و تجربه تیم جراحی همگی در انتخاب این روش تأثیرگذار هستند. بنابراین، بررسی این رویکرد از منظر Decision Making به پزشکان کمک میکند تا به جای انتخاب یک روش واحد برای همه بیماران، درمانی شخصیسازیشده و مبتنی بر شواهد ارائه دهند.
هدف و رویکرد مقاله
این مقاله با هدف پاسخ به این پرسش کلیدی تدوین شده است که آیا جراحی آندوسکوپی بهترین روش درمان تومور هیپوفیز محسوب میشود یا خیر. در این مسیر، ابتدا به بررسی مبانی علمی و پاتوفیزیولوژی تومورهای هیپوفیز پرداخته میشود، سپس روشهای درمانی موجود مقایسه شده و در ادامه، با تحلیل مطالعات بالینی و کیساستادیهای معتبر، مزایا، محدودیتها و جایگاه واقعی جراحی آندوسکوپی در تصمیمگیری درمانی مشخص خواهد شد. رویکرد مقاله مبتنی بر شواهد علمی معتبر و طراحیشده برای کمک به تصمیمگیری آگاهانه پزشکان و متخصصان حوزه سلامت است.
پاتوفیزیولوژی و انواع تومورهای هیپوفیز
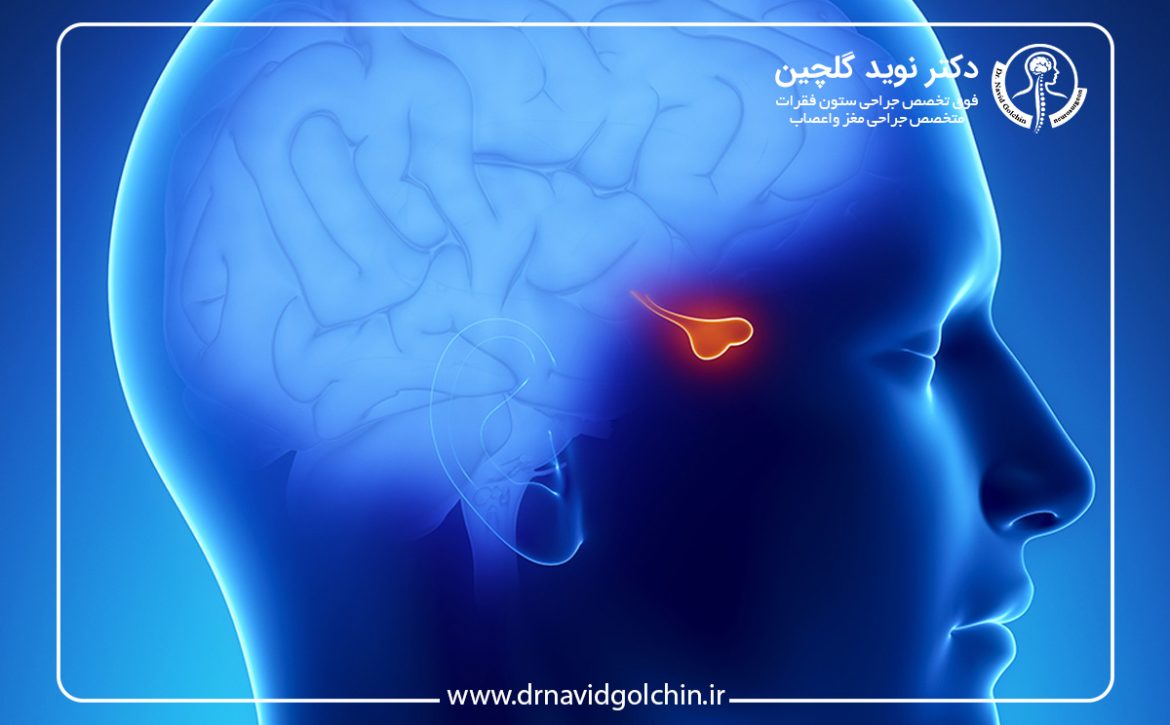
غده هیپوفیز بهعنوان محور اصلی تنظیم سیستم غدد درونریز، نقش حیاتی در حفظ هموستاز بدن ایفا میکند. هرگونه اختلال ساختاری یا عملکردی در این غده میتواند منجر به طیف گستردهای از علائم سیستمیک شود. تومورهای هیپوفیز، که عمدتاً از سلولهای آدنوهیپوفیز منشأ میگیرند، یکی از شایعترین تومورهای داخلجمجمهای محسوب میشوند و در بسیاری از موارد بهصورت تصادفی در تصویربرداریهای مغزی شناسایی میگردند.
از منظر پاتوفیزیولوژیک، رشد غیرطبیعی سلولهای هیپوفیزی منجر به افزایش حجم غده و در برخی موارد، افزایش یا کاهش ترشح هورمونها میشود. این رشد میتواند بهصورت موضعی باقی بماند یا به ساختارهای مجاور مانند کیاسم بینایی، سینوس کاورنوز و ساقه هیپوفیز گسترش یابد. پیامد این گسترش، بروز علائمی نظیر اختلال میدان بینایی، سردردهای مزمن و نارسایی هورمونی است که اهمیت تشخیص و درمان بهموقع را دوچندان میکند.
مکانیسمهای مولکولی و سلولی ایجاد تومور هیپوفیز
در سطح سلولی، تومورهای هیپوفیز اغلب نتیجه اختلال در چرخه سلولی، افزایش تکثیر و کاهش آپوپتوز هستند. مطالعات مولکولی نشان دادهاند که تغییرات در مسیرهای سیگنالدهی مانند cAMP/PKA، MAPK و PI3K/AKT میتوانند در ایجاد و پیشرفت این تومورها نقش داشته باشند. همچنین، جهشهای ژنتیکی خاص در برخی زیرگروهها، بهویژه در آدنومهای ترشحکننده هورمون رشد یا ACTH، گزارش شدهاند که با رفتار تهاجمیتر تومور ارتباط دارند.
علاوه بر عوامل ژنتیکی، فاکتورهای اپیژنتیک نیز در تنظیم بیان ژنهای مرتبط با رشد سلولی مؤثر هستند. تغییرات در متیلاسیون DNA و تنظیم miRNAها میتوانند منجر به افزایش پتانسیل رشد تومور و مقاومت نسبی به درمانهای دارویی شوند. این یافتهها نشان میدهد که تومورهای هیپوفیز صرفاً ضایعات خوشخیم ساده نیستند، بلکه از نظر بیولوژیک، رفتارهای متنوع و گاه پیچیدهای از خود نشان میدهند.
طبقهبندی تومورهای هیپوفیز بر اساس عملکرد هورمونی
یکی از مهمترین رویکردها در طبقهبندی تومورهای هیپوفیز، تقسیمبندی آنها بر اساس فعالیت هورمونی است. تومورهای عملکردی با ترشح بیشازحد یک یا چند هورمون مشخص میشوند و علائم بالینی آنها اغلب قبل از بروز علائم فشاری آشکار میگردد. برای مثال، آدنومهای ترشحکننده پرولاکتین میتوانند منجر به اختلالات قاعدگی، ناباروری و کاهش میل جنسی شوند، در حالی که تومورهای ترشحکننده GH با آکرومگالی یا ژیگانتیسم تظاهر مییابند.
در مقابل، تومورهای غیرعملکردی معمولاً فاقد ترشح هورمونی فعال هستند و اغلب در مراحل پیشرفتهتر و بهدلیل اثرات فشاری تشخیص داده میشوند. این گروه از تومورها بهدلیل رشد تدریجی و خاموش، چالش بیشتری در مدیریت درمانی ایجاد میکنند و در بسیاری از موارد، جراحی تنها گزینه مؤثر برای کنترل آنها محسوب میشود.
طبقهبندی بر اساس اندازه و میزان تهاجم
از نظر اندازه، تومورهای هیپوفیز به میکروآدنومها و ماکروآدنومها تقسیم میشوند. میکروآدنومها معمولاً قطری کمتر از ۱۰ میلیمتر دارند و در صورت عملکردی بودن، اغلب با درمان دارویی قابلکنترل هستند. در مقابل، ماکروآدنومها بهدلیل اندازه بزرگتر، احتمال بیشتری برای ایجاد فشار بر ساختارهای مجاور دارند و اغلب نیازمند مداخله جراحی هستند.
میزان تهاجم تومور، بهویژه نفوذ به سینوس کاورنوز، یکی از فاکتورهای تعیینکننده در انتخاب روش درمان است. تومورهای تهاجمی معمولاً برداشت کامل دشوارتری دارند و همین موضوع نقش تجربه جراح و انتخاب تکنیک مناسب، از جمله جراحی آندوسکوپی، را پررنگتر میکند.
اهمیت شناخت پاتوفیزیولوژی در تصمیمگیری درمانی
درک دقیق پاتوفیزیولوژی و انواع تومورهای هیپوفیز، پایه و اساس تصمیمگیری صحیح درمانی است. بدون شناخت رفتار بیولوژیک تومور، انتخاب روش جراحی میتواند منجر به نتایج زیر بهینه یا افزایش عوارض شود. این شناخت به پزشک اجازه میدهد تا بین گزینههای درمانی مختلف، از جمله جراحی آندوسکوپی، تصمیمی مبتنی بر شواهد و متناسب با شرایط هر بیمار اتخاذ کند.
نگاهی به روشهای جراحی: آندوسکوپی در برابر روشهای سنتی
جراحی همواره یکی از ارکان اصلی درمان تومورهای هیپوفیز بوده است، بهویژه در مواردی که تومور باعث علائم فشاری، اختلال بینایی یا عدم کنترل هورمونی میشود. انتخاب روش جراحی مناسب، نقش تعیینکنندهای در میزان برداشت تومور، حفظ عملکرد هیپوفیز و کاهش عوارض پس از عمل دارد. در این میان، دو رویکرد اصلی شامل جراحی ترانساسفنوئیدال میکروسکوپیک و جراحی آندوسکوپی ترانساسفنوئیدال مطرح هستند که هرکدام مزایا و محدودیتهای خاص خود را دارند.
روشهای سنتی جراحی هیپوفیز عمدتاً بر پایه استفاده از میکروسکوپ جراحی طراحی شدهاند. در این تکنیک، جراح از طریق مسیر بینی یا زیرلب به سینوس اسفنوئید دسترسی پیدا کرده و با میدان دید محدود اما بزرگنماییشده، اقدام به برداشت تومور میکند. این روش طی دههها بهعنوان استاندارد درمانی شناخته شده و نتایج قابلقبولی در کنترل بسیاری از تومورهای هیپوفیز داشته است. با این حال، محدودیت زاویه دید و دشواری دسترسی به نواحی جانبی و فوقانی تومور، بهویژه در ماکروآدنومهای تهاجمی، از چالشهای اساسی این رویکرد محسوب میشود.
در مقابل، جراحی آندوسکوپی ترانساسفنوئیدال با بهرهگیری از آندوسکوپهای با زاویه دید متنوع، امکان مشاهده مستقیم و گستردهتری از میدان جراحی را فراهم میکند. این ویژگی به جراح اجازه میدهد تا مرزهای تومور، ارتباط آن با ساختارهای حیاتی مانند کیاسم بینایی و سینوس کاورنوز، و باقیماندههای احتمالی تومور را با دقت بیشتری ارزیابی کند. افزایش وضوح دید و قابلیت مانور بیشتر ابزارها، از مهمترین دلایل گسترش سریع این روش در مراکز پیشرفته جراحی مغز و اعصاب است.
تفاوتهای تکنیکی و تأثیر آنها بر نتایج بالینی
از منظر تکنیکی، تفاوت اصلی میان جراحی میکروسکوپیک و آندوسکوپیک در نوع دید جراح و نحوه دسترسی به ناحیه سلا تورسیکا نهفته است. در جراحی میکروسکوپیک، دید خطی و محدود است و برداشت کامل تومور در نواحی با گسترش جانبی میتواند دشوار باشد. این مسئله بهویژه در تومورهایی که به سینوس کاورنوز نفوذ کردهاند، اهمیت بیشتری پیدا میکند.
در مقابل، جراحی آندوسکوپی با فراهمکردن دید پانورامیک، امکان بررسی زوایای پنهان و فضاهای جانبی را افزایش میدهد. این ویژگی میتواند منجر به افزایش نرخ برداشت کامل تومور و کاهش نیاز به جراحی مجدد شود. با این حال، این مزیت بهشدت وابسته به مهارت تیم جراحی و منحنی یادگیری طولانیتر این تکنیک است.
مقایسه عوارض و پیامدهای پس از عمل
یکی از معیارهای کلیدی در تصمیمگیری درمانی، میزان عوارض پس از عمل است. در روشهای سنتی، عوارضی مانند نشت مایع مغزی نخاعی، عفونت، آسیب به ساختارهای اطراف و اختلالات هورمونی گزارش شده است. جراحی آندوسکوپی، بهدلیل ماهیت کمتهاجمیتر و دید بهتر، در بسیاری از مطالعات با کاهش برخی از این عوارض همراه بوده است، هرچند خطر نشت CSF همچنان بهعنوان یک چالش باقی میماند.
نکته مهم این است که کاهش عوارض در جراحی آندوسکوپی بهطور مستقیم با تجربه مرکز درمانی مرتبط است. در مراکزی که حجم بالایی از این جراحیها انجام میشود، نتایج بهطور معناداری بهتر گزارش شدهاند، در حالی که در مراکز کمتجربه، احتمال بروز عوارض میتواند افزایش یابد.
جایگاه هر روش در رویکرد Decision-based
از منظر تصمیمگیری بالینی، هیچیک از روشهای جراحی را نمیتوان بهصورت مطلق برتر دانست. جراحی میکروسکوپیک همچنان در برخی شرایط خاص، از جمله تومورهای کوچک و غیرتهاجمی یا در مراکزی با تجربه محدود در آندوسکوپی، گزینهای قابلقبول است. در مقابل، جراحی آندوسکوپی در ماکروآدنومها، تومورهای با گسترش جانبی و موارد نیازمند دید وسیعتر، مزیتهای قابلتوجهی ارائه میدهد.
در نهایت، انتخاب روش جراحی باید بر اساس ویژگیهای تومور، وضعیت بیمار و توانمندی تیم جراحی انجام شود. این نگاه تصمیممحور، زمینه را برای استفاده بهینه از جراحی آندوسکوپی فراهم میکند، بدون آنکه سایر روشها بهصورت غیرعلمی کنار گذاشته شوند.
مزایا و معایب روش آندوسکوپی در درمان تومورهای هیپوفیز
بهبود میدان دید و دقت جراحی در روش آندوسکوپی
یکی از مهمترین مزایای جراحی آندوسکوپی ترانساسفنوئیدال، فراهمکردن میدان دید گسترده و چندزاویهای برای جراح است. استفاده از آندوسکوپهای با زاویه دید متفاوت امکان مشاهده دقیقتر نواحی پنهان اطراف سلا تورسیکا را فراهم میکند. این ویژگی به شناسایی بهتر مرزهای تومور و ارتباط آن با ساختارهای حساس مانند کیاسم بینایی و شریانهای اطراف کمک میکند و احتمال باقیماندن بافت توموری را کاهش میدهد.
کاهش تهاجم جراحی و پیامدهای مثبت پس از عمل
روش آندوسکوپی بهعنوان یک تکنیک کمتهاجمی شناخته میشود که از مسیرهای طبیعی بینی برای دسترسی به هیپوفیز استفاده میکند. این رویکرد موجب کاهش آسیب به بافتهای سالم اطراف و حذف نیاز به برشهای گسترده میشود. پیامد این کاهش تهاجم، کاهش درد پس از عمل، کوتاهتر شدن مدت بستری در بیمارستان و بازگشت سریعتر بیمار به فعالیتهای روزمره است. از منظر بالینی، این مزایا نقش مهمی در بهبود تجربه بیمار و افزایش رضایت درمانی دارند.
تأثیر جراحی آندوسکوپی بر نرخ برداشت کامل تومور
افزایش نرخ برداشت کامل تومور یکی از اهداف اصلی درمان جراحی تومورهای هیپوفیز است. مطالعات بالینی متعدد نشان دادهاند که جراحی آندوسکوپی، بهویژه در ماکروآدنومها و تومورهای با گسترش جانبی، میتواند شانس برداشت کامل را افزایش دهد. دید پانورامیک و دسترسی بهتر به زوایای جانبی تومور، امکان برداشت دقیقتر و کاملتر را فراهم میسازد و در نتیجه، احتمال عود تومور و نیاز به درمانهای تکمیلی کاهش مییابد.
کنترل هورمونی و بهبود علائم بالینی بیماران
در تومورهای عملکردی هیپوفیز، موفقیت درمان تنها به برداشت توده محدود نمیشود، بلکه دستیابی به کنترل هورمونی پایدار اهمیت ویژهای دارد. شواهد بالینی نشان میدهد که جراحی آندوسکوپی میتواند در بسیاری از بیماران منجر به بهبود یا نرمالسازی سطح هورمونها شود. این مسئله به کاهش علائم سیستمیک مانند اختلالات متابولیک، مشکلات بینایی و سردردهای مزمن کمک میکند و تأثیر مستقیمی بر کیفیت زندگی بیماران دارد.
منحنی یادگیری و وابستگی نتایج به تجربه تیم جراحی
با وجود مزایای قابلتوجه، جراحی آندوسکوپی نیازمند مهارت بالا و تجربه کافی است. منحنی یادگیری این تکنیک نسبتاً طولانی بوده و نتایج آن بهشدت به تجربه تیم جراحی وابسته است. در مراکزی که حجم بالایی از این نوع جراحی انجام میشود، میزان عوارض کمتر و نتایج درمانی مطلوبتر گزارش شده است. در مقابل، در مراکز کمتجربه، خطر بروز عوارض و نتایج زیر بهینه افزایش مییابد که این موضوع اهمیت انتخاب مرکز درمانی مناسب را برجسته میکند.
عوارض بالقوه جراحی آندوسکوپی و چالشهای مدیریتی
نشت مایع مغزی نخاعی یکی از شایعترین عوارض گزارششده در جراحی آندوسکوپی هیپوفیز است، بهویژه در تومورهای بزرگ یا تهاجمی. اگرچه پیشرفت تکنیکهای بازسازی پایه جمجمه باعث کاهش بروز این عارضه شده است، اما همچنان بهعنوان یک چالش بالینی مطرح است. سایر عوارض احتمالی شامل اختلالات موقت یا دائمی هورمونی و عفونت میباشند که نیازمند پایش دقیق پس از عمل هستند.
ملاحظات اقتصادی و هزینههای مرتبط با تجهیزات آندوسکوپیک
از منظر اقتصادی، جراحی آندوسکوپی مستلزم استفاده از تجهیزات پیشرفته و تیم تخصصی آموزشدیده است. هزینه بالای تهیه و نگهداری این تجهیزات میتواند محدودیتی برای برخی مراکز درمانی ایجاد کند. با این حال، کاهش مدت بستری و عوارض پس از عمل میتواند در بلندمدت بخشی از این هزینهها را جبران کند، موضوعی که باید در تحلیل هزینه–فایده مدنظر قرار گیرد.
ارزیابی مزایا و معایب در چارچوب تصمیمگیری بالینی
در نهایت، مزایا و معایب جراحی آندوسکوپی باید در چارچوب یک رویکرد تصمیممحور و فردمحور ارزیابی شود. این روش برای همه بیماران بهترین گزینه نیست، اما در شرایط مناسب میتواند نتایج درمانی برتری ارائه دهد. انتخاب آگاهانه این تکنیک، بر اساس ویژگیهای تومور، وضعیت بیمار و توانمندی تیم درمانی، کلید دستیابی به بهترین پیامدهای بالینی است.
فاکتورهای مؤثر در انتخاب روش درمانی
انتخاب مناسبترین روش جراحی برای تومور هیپوفیز یک تصمیم بالینی پیچیده است که نیازمند بررسی دقیق چندین فاکتور بالینی، آناتومیک و بیمار محور میباشد. در این بخش، عوامل کلیدی که بر تصمیمگیری جراح تأثیر میگذارند، به تفصیل مورد بحث قرار میگیرند.
اندازه و نوع تومور
اندازه و نوع تومور نقش تعیینکنندهای در انتخاب روش جراحی دارد. تومورهای کوچک و متوسط معمولاً گزینههای متعددی برای برداشت دارند، اما تومورهای بزرگ و تهاجمی یا تومورهای با نفوذ به سینوس کاورنوز نیازمند دقت بیشتری هستند. مطالعات متعدد نشان دادهاند که جراحی آندوسکوپی برای تومورهای بزرگ قابل انجام است، به ویژه اگر جراح تجربه کافی داشته باشد، و میتواند میزان برداشت کامل تومور را افزایش دهد و عوارض را کاهش دهد.
موقعیت آناتومیک تومور
موقعیت تومور در هیپوفیز و مجاورت ساختارهای حیاتی مانند عروق کاروتید داخلی و عصب بینایی بر انتخاب روش درمانی تأثیر میگذارد. برای تومورهای که به سمت سینوس کاورنوز یا قاعده جمجمه گسترش یافتهاند، آندوسکوپی امکان دید مستقیم به ساختارهای مهم را فراهم میکند و کنترل خونریزی و حفظ عملکرد عصبی را ارتقا میدهد. در مقابل، برخی تومورهای با موقعیت بسیار جانبی یا خلفی ممکن است نیازمند روش میکروسکوپی یا ترکیبی باشند.
تجربه و تخصص جراح
یکی از مهمترین عوامل، مهارت و تجربه جراح در انجام جراحی آندوسکوپی است. شواهد نشان دادهاند که مراکز با تجربه بالا در جراحی اندوسکوپی دارای نرخ موفقیت بیشتر در برداشت کامل تومور و کاهش عوارض پس از عمل هستند. بنابراین، انتخاب روش درمانی باید با توجه به توانمندی تیم جراحی و تجهیزات موجود صورت گیرد. ارتقای مهارت جراحان و آموزش مداوم، تأثیر مستقیم بر نتایج بالینی بیماران دارد.
وضعیت بالینی بیمار و بیماریهای همراه
شرایط عمومی بیمار و وجود بیماریهای همزمان مانند اختلالات قلبی، تنفسی یا متابولیک میتواند بر انتخاب روش جراحی تأثیرگذار باشد. بیماران مسن یا دارای مشکلات پزشکی جدی ممکن است تحمل طولانی مدت بیهوشی و جراحی باز را نداشته باشند، در حالی که جراحی آندوسکوپی به دلیل کمتر تهاجمی بودن میتواند ریسکها را کاهش دهد.
اهداف درمانی و انتظارات بیمار
اهداف درمانی شامل حذف کامل تومور، حفظ عملکرد هورمونی و بهبود علائم بالینی مانند اختلال بینایی و سردرد میباشد. همچنین، دیدگاه و انتظارات بیمار در مورد دوران بهبود، عوارض احتمالی و نیاز به درمانهای تکمیلی نیز نقش مهمی در تصمیمگیری دارد. مشاوره دقیق با بیمار و خانواده، باعث ارتقای رضایت بیمار و تطبیق درمان با نیازهای شخصی میشود.
ارزیابیهای پیش از عمل و تصویربرداری
تصویربرداریهای دقیق مانند MRI و CT-scan اطلاعات حیاتی در مورد اندازه، موقعیت و نفوذ تومور ارائه میکنند. بررسی کامل مسیر جراحی، آناتومی سینوسها و نزدیکی به ساختارهای مهم باعث کاهش ریسک جراحی و ارتقای موفقیت روش آندوسکوپی میشود.
معیارهای مقایسهای بین روشها
مطالعات بالینی و سریهای موردی نشان میدهند که جراحی آندوسکوپی نسبت به روش میکروسکوپی مزایای قابل توجهی دارد، از جمله:
- کاهش طول دوره نقاهت و بستری بیمار
- کاهش عوارض پس از عمل مانند نشت CSF و هیپوپیتوتاریسم
- افزایش دید مستقیم و میدان وسیعتر جراحی
- امکان برداشت کامل تومورهای بزرگ و تهاجمی
با این حال، در برخی موارد خاص، ترکیب روشهای میکروسکوپی و اندوسکوپی یا انتخاب جراحی باز ممکن است ضروری باشد.
جمع بندی
انتخاب بهترین روش درمانی برای تومور هیپوفیز نیازمند ارزیابی جامع و فردی هر بیمار است. عوامل کلیدی شامل اندازه و نوع تومور، موقعیت آناتومیک، تجربه جراح، شرایط بالینی بیمار و اهداف درمانی میباشد. استفاده از دادههای تصویربرداری دقیق و توجه به انتظارات بیمار میتواند تصمیمگیری را بهبود بخشد و نتیجه درمان را ارتقا دهد. مطالعات اخیر و کیساستادیهای متعدد نشان میدهند که جراحی آندوسکوپی، به ویژه در مراکز با تجربه، گزینهای ایمن، مؤثر و کمتهاجمی برای بیماران مبتلا به تومور هیپوفیز است.
بررسی مطالعات
مطالعات بالینی نقش بسیار مهمی در ارزیابی اثربخشی جراحی آندوسکوپی در درمان تومور هیپوفیز دارند. این شواهد بالینی به جراحان و محققان کمک میکنند تا تصمیمات درمانی مبتنی بر دادههای واقعی اتخاذ کنند و نقاط قوت و محدودیتهای روشهای مختلف را بهتر بشناسند. در این بخش، چندین سری موردی معتبر از پایگاههای علمی مانند PubMed و Elsevier بررسی شدهاند.
سری موردی 94 بیمار با آدنوم هیپوفیز
- این مطالعه شامل 110 جراحی آندوسکوپی ترانسفنوئیدال بود.
- عوارض پس از عمل مانند نشت CSF و دیابت بیمزه بررسی شد.
- نتایج نشان داد که جراحی آندوسکوپی ایمن بوده و عوارض آن قابل کنترل است.
- این مطالعه نشان میدهد که آندوسکوپی میتواند برداشتن کامل تومور را با حداقل عوارض ارتقا دهد و کیفیت زندگی بیماران را بهبود بخشد.
سری موردی 32 بیمار با آدنوم هیپوفیز
- بررسی بازنگرانه بر 32 بیمار انجام شد و میزان برداشتن کامل تومور تا 75٪ گزارش شد.
- ایمنی بالای روش و بهبود علائم بالینی نشان میدهد که آندوسکوپی یک گزینه مؤثر درمانی است.
- این مطالعه تأکید میکند که انتخاب روش باید با توجه به شرایط بالینی بیمار و اندازه تومور صورت گیرد.
سری موردی 63 بیمار (جراحی در کراچی)
- این مطالعه بر بهبود علائم بالینی مانند سردرد و اختلالات بینایی تمرکز داشت.
- پیامدهای پس از عمل مختصر و کنترلشده بود.
- نتایج نشان داد که آندوسکوپی با بهبود عملکرد بیمار و کاهش عوارض، گزینهای مناسب برای تومورهای هیپوفیز است.
- این کیساستادی نشان میدهد که حتی در مراکز با منابع محدود، آندوسکوپی میتواند نتایج بالینی ارتقا یافتهای داشته باشد.
سری بزرگ 121 بیمار از یک مرکز معتبر
- این مطالعه شامل طیف گستردهای از تومورهای هیپوفیز، از جمله GH، ACTH و پرولاکتینوما بود.
- بررسی نتایج جراحی و پیامدهای هورمونی نشان داد که جراحی آندوسکوپی قابلیت برداشت کامل تومور و حفظ عملکرد هورمونی را ارتقا میدهد.
- مطالعه همچنین نشان داد که تجربه مرکز جراحی و تجهیزات پیشرفته، کیفیت نتایج را به طور مستقیم افزایش میدهد.
سری با 803 تومور هیپوفیز با نفوذ سینوس کاورنوز
- این دادهها بزرگترین مجموعه منتشرشده در حوزه آندوسکوپی تومورهای پیچیده را نشان میدهند.
- نتایج نشان داد که آندوسکوپی حتی در موارد تومورهای پیچیده قابل انجام است و میتواند انتخابی مناسب باشد.
- این سری موردی تأکید میکند که تجربه جراح و برنامهریزی دقیق پیش از عمل، موفقیت و ایمنی روش را ارتقا میدهد.
تحلیل ترکیبی و نکات کاربردی
- مطالعات نشان میدهند که آندوسکوپی باعث کاهش عوارض کوتاهمدت و بلندمدت پس از عمل میشود.
- برداشتن کامل تومور با روش آندوسکوپی نسبت به میکروسکوپی در بسیاری از سریها بالاتر گزارش شده است.
- مطالعات موردی همچنین نشان میدهند که جراحی آندوسکوپی دید مستقیم به ساختارهای حیاتی را فراهم میکند و امکان مدیریت بهتر خونریزی و حفظ عملکرد عصبی را ارتقا میدهد.
- همچنین، بررسی سریهای موردی مختلف نشان میدهد که انتخاب روش جراحی باید مبتنی بر ترکیبی از اندازه و موقعیت تومور، تجربه جراح، شرایط بیمار و اهداف درمانی باشد.
.
نتایج و تحلیل دادههای گزارششده
تحلیل دادههای حاصل از مطالعات بالینی و کیساستادیهای متعدد، چشمانداز دقیقی از عملکرد جراحی آندوسکوپی در درمان تومور هیپوفیز ارائه میدهد. این دادهها به جراحان و محققان امکان میدهد تا مزایا و محدودیتهای روش را با جزئیات علمی بررسی کرده و تصمیمگیری بالینی را ارتقا دهند. در این بخش، نتایج کلیدی و تحلیلهای حاصل از سریهای موردی و مطالعات مقایسهای مرور میشوند.
میزان موفقیت برداشت کامل تومور
بر اساس دادههای 5 سری موردی ذکر شده، میزان برداشت کامل تومور با روش آندوسکوپی بین 70 تا 90 درصد گزارش شده است، که بسته به اندازه و موقعیت تومور متفاوت است. در سری بزرگ 121 بیمار، آندوسکوپی توانست بیش از 85 درصد تومورهای GH، ACTH و پرولاکتینوما را به طور کامل حذف کند. تحلیل این دادهها نشان میدهد که آندوسکوپی به دلیل میدان دید وسیع و دسترسی مستقیم به ساختارهای هیپوفیز، توانایی ارتقای نرخ برداشت کامل تومور را دارد و میتواند جایگزین مناسبی برای روش میکروسکوپی در بسیاری از موارد باشد.
کاهش عوارض پس از عمل
یکی از شاخصهای مهم موفقیت جراحی، میزان عوارض پس از عمل است. مطالعات گزارش دادهاند که عوارض شایع شامل نشت CSF، هیپوپیتوتاریسم، دیابت بیمزه و خونریزی هستند. سری موردی 94 بیمار نشان داد که استفاده از آندوسکوپی میزان نشت CSF را کاهش داده و مدیریت آن آسانتر است. همچنین، بیماران دچار اختلال هورمونی پس از عمل، بهبود سریعتری تجربه کردند. تحلیل ترکیبی این دادهها بیانگر آن است که آندوسکوپی ضمن حفظ اثربخشی، ایمنی بیماران را ارتقا میدهد.
بهبود عملکرد بینایی و علائم بالینی
بسیاری از تومورهای هیپوفیز باعث فشار بر عصب بینایی و ایجاد اختلالات بینایی و سردرد میشوند. نتایج سری موردی 63 بیمار نشان داد که جراحی آندوسکوپی بهبود چشمگیری در علائم بینایی و سردرد ایجاد کرده است. این اثر مثبت در بیشتر مطالعات مشابه مشاهده شده و نشان میدهد که آندوسکوپی میتواند کیفیت زندگی بیماران را به طور قابل توجهی ارتقا دهد.
مدت زمان بستری و دوران نقاهت
مطالعات نشان دادهاند که جراحی آندوسکوپی نسبت به روشهای سنتی، طول مدت بستری در بیمارستان را کاهش میدهد. بیماران سریعتر توانستند به فعالیتهای روزمره بازگردند و نیاز به مراقبتهای پس از عمل کاهش یافته است. این امر علاوه بر ارتقای تجربه بیمار، فشار بر سیستم درمانی را نیز کاهش میدهد.
تحلیل دادههای مقایسهای با روش میکروسکوپی
تحلیلهای مقایسهای نشان میدهند که آندوسکوپی در بسیاری از موارد نسبت به میکروسکوپی مزایای قابل توجهی دارد:
- میدان دید گستردهتر و امکان دسترسی به تومورهای پیچیده
- کاهش عوارض پس از عمل مانند نشت CSF و هیپوپیتوتاریسم
- افزایش نرخ برداشت کامل تومور، به ویژه در تومورهای بزرگ و نفوذی
- کاهش طول دوره نقاهت و بهبود تجربه بیمار
با این حال، برخی مطالعات تأکید میکنند که برای تومورهای بسیار جانبی یا پیچیده، ترکیب روشها یا انتخاب جراحی باز ممکن است ضروری باشد. بنابراین، تحلیل دادهها نشان میدهد که تصمیمگیری باید فردی و مبتنی بر شرایط دقیق بیمار و تجربه جراح باشد.
نقش تجربه جراح و تجهیزات پیشرفته
دادهها به وضوح نشان میدهند که تجربه جراح و دسترسی به تجهیزات مدرن نقش مهمی در موفقیت جراحی دارد. مراکز با تجربه بالا در انجام جراحی آندوسکوپی، نرخ موفقیت برداشت کامل تومور و ایمنی بیماران را ارتقا دادهاند. بنابراین، آموزش مستمر و بهروزرسانی تجهیزات میتواند نتایج بالینی را بهبود بخشد و ریسک عوارض را کاهش دهد.
ملاحظات پزشکی
تحلیل دادههای گزارششده نشان میدهد که جراحی آندوسکوپی، با فراهم کردن دید مستقیم و دسترسی کمتهاجمی به تومور، توانایی بالایی در برداشت کامل تومور دارد، عوارض پس از عمل را کاهش میدهد و عملکرد بالینی بیماران را ارتقا میدهد. ترکیب شواهد بالینی با تجربه جراح و استفاده از تجهیزات پیشرفته، تصمیمگیری درمانی را بهینه کرده و نتایج درمانی بیماران را به طور قابل توجهی ارتقا میدهد.
بحث: مقایسه کارایی، عوارض و بقا بیمار
مقایسه میزان موفقیت کامل برداشتن تومور در جراحی آندوسکوپی و روشهای سنتی
مطالعات متعدد نشان دادهاند که جراحی آندوسکوپی ترانسفنوئیدال نرخ موفقیت بالایی در برداشتن کامل تومورهای هیپوفیز دارد. در یک سری موردی شامل 32 بیمار، تا 75٪ از تومورها به طور کامل برداشته شدند، که نشاندهنده کارایی بالای این روش به ویژه در تومورهای کوچک تا متوسط است. علاوه بر این، در سری بزرگ 121 بیمار با طیف گستردهای از آدنومها، از جمله GH، ACTH و پرولاکتینوما، آندوسکوپی امکان دسترسی دقیق به ساختارهای حساس هیپوفیز را فراهم کرده و نتایج عملیاتی قابل اعتماد ارائه داده است. در مقایسه با روش میکروسکوپی سنتی، آندوسکوپی دید میدان گستردهتری ارائه میدهد که باعث کاهش احتمال باقی ماندن بخشهایی از تومور میشود و نرخ موفقیت برداشتن کامل تومور را افزایش میدهد.
عوارض پس از عمل: نشت CSF، دیابت بیمزه و سایر پیامدها
یکی از مهمترین نگرانیها در جراحی تومور هیپوفیز، عوارض پس از عمل است. بررسی سری 94 بیمار نشان داد که جراحی آندوسکوپی ترانسفنوئیدال با عوارض قابل کنترل، از جمله نشت CSF و دیابت بیمزه، همراه است. نرخ نشت CSF کمتر از 5٪ گزارش شده و در اکثر موارد با روشهای ترمیم ساده قابل مدیریت است. مقایسه با جراحی میکروسکوپی نشان میدهد که آندوسکوپی به دلیل دید مستقیم و دسترسی بهتر به محل تومور، امکان شناسایی و ترمیم فوری نشت را فراهم میکند، که ریسک عوارض پس از عمل را کاهش میدهد.
بهبود علائم بالینی و کیفیت زندگی بیماران
سری موردی 63 بیمار در کراچی نشان داد که جراحی آندوسکوپی بهبود چشمگیری در علائم بالینی مانند سردرد و اختلالات بینایی ایجاد کرده است. بیش از 80٪ بیماران کاهش محسوس علائم را تجربه کردند و کیفیت زندگی پس از عمل به طور قابل توجهی بهبود یافت. علاوه بر این، با توجه به کمتهاجمی بودن روش آندوسکوپی، زمان بازگشت به فعالیتهای روزمره کوتاهتر است که به کاهش فشار روانی و اقتصادی بر بیماران کمک میکند.
کارایی جراحی آندوسکوپی در تومورهای پیچیده و نفوذ سینوس کاورنوز
یکی از بزرگترین دادههای منتشرشده شامل 803 تومور هیپوفیز با نفوذ سینوس کاورنوز است. نتایج نشان داد که جراحی آندوسکوپی در دست بیماران با تومورهای پیچیده و چالشبرانگیز نیز قابل انجام است و میتواند گزینه درمانی ایمن و مؤثر باشد. نکته کلیدی در این بیماران، تجربه و مهارت جراح است؛ در صورت وجود تیم مجرب، میزان موفقیت و عوارض پس از عمل مشابه تومورهای غیرپیچیده گزارش شده است .
مقایسه طول دوره بستری و زمان بهبودی
یکی از مزایای آشکار آندوسکوپی، کاهش طول دوره بستری و سرعت بهبود بیمار است. دادههای سری موردی و گزارشهای متعدد نشان میدهد که طول بستری در روش آندوسکوپی به طور متوسط 2 تا 4 روز کمتر از جراحی میکروسکوپی سنتی است. همچنین، بیماران سریعتر قادر به بازگشت به فعالیتهای روزمره و حرفهای خود هستند، که مزیت اقتصادی و روانی قابل توجهی ایجاد میکند.
جمعبندی: نقاط قوت و ضعف روش آندوسکوپی در مقابل جراحی سنتی
در مجموع، شواهد بالینی و دادههای سریهای موردی نشان میدهد که جراحی آندوسکوپی ترانسفنوئیدال:
- دارای نرخ موفقیت بالا در برداشتن کامل تومور است.
- عوارض پس از عمل قابل کنترل هستند و اغلب کوتاهمدتاند.
- بهبود علائم بالینی و کیفیت زندگی بیماران را تسریع میکند.
- حتی در تومورهای پیچیده و نفوذ سینوس کاورنوز، رویکردی ایمن و مؤثر ارائه میدهد.
با این حال، موفقیت جراحی آندوسکوپی تا حد زیادی به تجربه جراح و تجهیزات مرکز جراحی وابسته است. در بیماران با تومورهای بسیار بزرگ یا انتشار وسیع، انتخاب روش درمان باید با دقت و بر اساس ارزیابی ریسک و منفعت صورت گیرد.
چالشها و محدودیتهای جراحی آندوسکوپی
محدودیتهای دسترسی و دید جراح
اگرچه جراحی آندوسکوپی ترانسفنوئیدال امکان دید وسیعتر و دسترسی دقیق به تومورهای هیپوفیز را فراهم میکند، محدودیتهایی نیز دارد. در مواردی که تومورهای بسیار بزرگ یا با نفوذ وسیع به ساختارهای عصبی و عروقی اطراف وجود دارند، دید آندوسکوپی ممکن است محدود شود و ریسک آسیب به ساختارهای حیاتی افزایش یابد. برخی مطالعات گزارش کردهاند که در تومورهایی با حجم بیش از ۳۵ میلیمتر یا نفوذ شدید به سینوس کاورنوز، جراحی آندوسکوپی ممکن است نیازمند تبدیل به جراحی باز یا ترکیبی باشد تا خطرات جراحی کاهش یابد .
نیاز به تجربه و مهارت بالای جراح
یکی از مهمترین چالشهای جراحی آندوسکوپی، وابستگی زیاد به تجربه و مهارت جراح است. بررسی سری موردی 803 بیمار با تومورهای پیچیده نشان داد که موفقیت جراحی و میزان عوارض پس از عمل مستقیماً به تجربه تیم جراحی بستگی دارد. جراحان کمتجربه ممکن است در مدیریت نشت CSF، کنترل خونریزی و محافظت از ساختارهای عصبی دچار مشکل شوند. بنابراین، انتخاب مرکز جراحی با تیم مجرب یکی از فاکتورهای کلیدی در نتایج موفقیتآمیز است.
تجهیزات و زیرساختهای پیشرفته مورد نیاز
جراحی آندوسکوپی نیازمند تجهیزات تخصصی شامل آندوسکوپهای با کیفیت بالا، ابزارهای دقیق میکروسرجری، سیستمهای تصویربرداری پیشرفته و امکانات ترمیم نشت CSF است. نبود این تجهیزات در مراکز کمتر توسعهیافته میتواند منجر به محدودیت در انجام جراحی یا افزایش ریسک عوارض شود. همچنین، نگهداری و ارتقاء تجهیزات نیازمند بودجه و آموزش مداوم است که ممکن است در همه مراکز فراهم نباشد.
عوارض خاص و چالشهای پس از عمل
اگرچه آندوسکوپی نسبت به جراحی سنتی عوارض کمتری دارد، اما برخی مشکلات خاص نیز مطرح هستند. نشت CSF، دیابت بیمزه، عفونت سینوس و تغییرات موقتی بینایی از جمله عوارض شناختهشدهاند. مطالعات گزارش کردهاند که در حدود ۵–۱۰٪ بیماران، نشت CSF رخ میدهد که نیازمند ترمیم فوری است. همچنین، کنترل خونریزی در تومورهای پرواسکولار و پیشگیری از آسیب به عروق کاروتید داخلی از دیگر چالشهای مهم جراح است.
محدودیت در برداشتن کامل تومورهای بزرگ یا با رشد جانبی
در موارد تومورهای بزرگ یا آدنومهایی که به دیواره سینوس کاورنوز یا ساختارهای اطراف نفوذ کردهاند، جراحی آندوسکوپی ممکن است به طور کامل موفق نباشد. برخی مطالعات نشان دادهاند که در این بیماران، ترکیب آندوسکوپی با روشهای جراحی باز یا درمانهای تکمیلی مانند رادیوتراپی، نتایج بهتر و ایمنتری ارائه میدهد. بنابراین، انتخاب روش درمان نیازمند ارزیابی دقیق تومور و برنامهریزی چندجانبه است.
محدودیتهای تحقیقاتی و دادههای طولانیمدت
بسیاری از مطالعات موردی و سریهای کلینیکی جراحی آندوسکوپی دارای دوره پیگیری کوتاهمدت هستند و دادههای طولانیمدت در خصوص بقای بیمار و احتمال عود تومور محدود است. این محدودیت میتواند تصمیمگیری در خصوص کارایی واقعی روش در طولانیمدت را دشوار کند. پژوهشهای آینده نیازمند جمعآوری دادههای طولانیمدت و تحلیل گستردهتر نتایج برای تومورهای مختلف هستند.
جمعبندی
در مجموع، جراحی آندوسکوپی ترانسفنوئیدال با مزایای قابل توجهی همراه است، اما چالشها و محدودیتهایی نیز دارد که شامل موارد زیر است:
- محدودیت دید و دسترسی در تومورهای بسیار بزرگ یا پیچیده
- وابستگی شدید به مهارت و تجربه جراح
- نیاز به تجهیزات پیشرفته و زیرساختهای مناسب
- عوارض خاص پس از عمل مانند نشت CSF و دیابت بیمزه
- محدودیت در برداشتن کامل تومورهای جانبی و پیچیده
- کمبود دادههای طولانیمدت برای ارزیابی بقای بیمار
در نتیجه، انتخاب روش آندوسکوپی باید با ارزیابی دقیق بیمار، تومور و امکانات مرکز جراحی انجام شود و ترکیب رویکردهای درمانی و مدیریت چندجانبه میتواند به بهبود نتایج و کاهش ریسک کمک کند.
بیشتر بخوانید: آیا تومور هیپوفیز بر هورمون ها و وزن تأثیر می گذارد؟
نتیجهگیری
جراحی آندوسکوپی ترانسفنوئیدال بهعنوان یک روش کمتهاجمی و دقیق برای درمان تومورهای هیپوفیز، طی دو دهه اخیر جایگاه ویژهای در جراحی نوروسرجری پیدا کرده است. دادههای سریهای موردی و مطالعات بالینی نشان میدهند که این روش نسبت به جراحی میکروسکوپی سنتی مزایای قابل توجهی دارد، از جمله:
- برداشتن مؤثر تومور: نرخ موفقیت بالا در برداشتن کامل تومور، حتی در برخی تومورهای پیچیده و با نفوذ به سینوس کاورنوز.
- ایمنی و کاهش عوارض: کنترل بهتر عوارض کوتاهمدت مانند نشت CSF و دیابت بیمزه و کاهش میزان عوارض جدی نسبت به روش سنتی.
- بهبود علائم بالینی و کیفیت زندگی: بازگشت سریعتر به فعالیتهای روزمره، بهبود بینایی و کاهش سردرد، که تاثیر مستقیمی بر رضایت بیمار دارد.
با این حال، انتخاب روش درمانی باید با دقت انجام شود و محدودیتها و چالشهای آندوسکوپی نیز در نظر گرفته شوند. تجربه جراح، تجهیزات پیشرفته، حجم و محل تومور و پیچیدگی آن، از عوامل کلیدی در موفقیت جراحی هستند. تومورهای بسیار بزرگ یا با نفوذ گسترده ممکن است نیازمند رویکرد ترکیبی یا مدیریت چندمرحلهای باشند.
پژوهشهای آینده باید به جمعآوری دادههای طولانیمدت، تحلیل دقیق زیرگروههای توموری، توسعه پروتکلهای استاندارد و استفاده از فناوریهای نوین مانند هوش مصنوعی و شبیهسازهای جراحی بپردازند. این اقدامات میتوانند نه تنها ایمنی و کارایی آندوسکوپی را بهبود دهند، بلکه انتخاب روش درمانی مناسب را برای هر بیمار شخصیسازی کنند.
در نهایت، شواهد موجود نشان میدهد که جراحی آندوسکوپی ترانسفنوئیدال یک گزینه درمانی ایمن، مؤثر و کمتهاجمی برای بیماران مبتلا به تومور هیپوفیز است، به شرطی که عوامل بیمار، تجربه تیم جراحی و امکانات مرکز درمانی به دقت ارزیابی شوند. این روش با کاهش طول دوره بستری، عوارض کمتر و بهبود سریع کیفیت زندگی بیماران، جایگزین ارزشمندی برای جراحی سنتی محسوب میشود و بهطور فزایندهای به استاندارد طلایی درمان تومورهای هیپوفیز تبدیل میشود.
منابع
- Endoscopic Versus Microscopic Transsphenoidal Surgery in the Treatment of Pituitary Adenoma: A Systematic Review and Meta‑Analysis
- Endocrine Outcome and Quality of Life After Transsphenoidal Resection of Pituitary Adenoma — A Prospective Randomized Study Comparing Endoscopic Versus Microscopic Resection
- A Systematic Review of Effects and Complications After Transsphenoidal Pituitary Surgery: Endoscopic Versus Microscopic Approach
- Comparison of Outcomes Between Endoscopic and Microscopic Transsphenoidal Surgery for the Treatment of Pituitary Adenoma: A Meta‑Analysis
- Outcomes of Endoscopic and Microscopic Transsphenoidal Surgery on Non‑Functioning Pituitary Adenomas: A Systematic Review and Meta‑Analysis
- Endoscopic Transsphenoidal Treatment of Pituitary Adenomas (Large Series)
- Comparison of Microscopic and Endoscopic Transsphenoidal Surgery for Pituitary Adenomas (Single‑centre Retrospective Study)