تومور مغزی همیشه با سردرد شدید شروع میشود؟ واقعیتها و علائم پنهان
مقدمه
علائم تومور مغزی یکی از پرجستوجوترین و در عین حال نگرانکنندهترین موضوعات حوزه سلامت مغز و اعصاب است، زیرا بسیاری از افراد با بروز سردرد، سرگیجه یا تغییرات عصبی خفیف، بلافاصله به بدترین سناریوها فکر میکنند. این نگرانی اغلب از این باور رایج نشأت میگیرد که تومور مغزی همیشه با سردرد شدید و غیرقابلتحمل آغاز میشود؛ در حالی که شواهد علمی و مطالعات بالینی معتبر نشان میدهند واقعیت بسیار پیچیدهتر از این تصور عمومی است. برخی تومورها ممکن است در مراحل اولیه هیچ سردردی ایجاد نکنند و در مقابل، علائمی پنهان، تدریجی و گاه غیر اختصاصی بروز دهند که بهراحتی نادیده گرفته میشوند. هدف این مقاله ارائه نگاهی علمی، دقیق و تصمیممحور به این موضوع است تا ضمن کاهش ترس غیرضروری، به خواننده کمک کند تشخیص دهد چه علائمی نیازمند پیگیری پزشکی هستند و چه زمانی میتوان با آرامش و آگاهی تصمیم درستتری گرفت.
بخش اول: آیا سردرد شدید اولین علامت تومور مغزی است؟
برداشت عمومی از سردرد و تومور مغزی
در ذهن بسیاری از افراد، ارتباط مستقیمی میان سردرد شدید و علائم تومور مغزی وجود دارد. این برداشت عمومی باعث میشود هر سردرد غیرمعمول یا طولانیمدت بهعنوان نشانهای از یک بیماری خطرناک تلقی شود. در حالی که از دیدگاه پزشکی، سردرد یکی از شایعترین علائم در جمعیت عمومی است و در اغلب موارد هیچ ارتباطی با تومور مغزی ندارد. این شکاف میان تصور عمومی و واقعیت علمی، زمینهساز اضطراب گسترده در میان بیماران شده است.
سردرد بهعنوان علامت شایع اما غیر اختصاصی
سردرد از نظر بالینی یک علامت غیر اختصاصی محسوب میشود؛ به این معنا که میتواند در دهها بیماری مختلف، از مشکلات ساده تا اختلالات پیچیده عصبی، دیده شود. حتی در میان بیماران مبتلا به تومور مغزی نیز سردرد همیشه وجود ندارد و اگر هم وجود داشته باشد، الزاماً اولین علامت بیماری نیست. مطالعات نشان میدهند که درصد قابل توجهی از بیماران در زمان تشخیص، علائم دیگری غیر از سردرد را تجربه کردهاند.
نقش ساختارهای حساس به درد در بروز سردرد
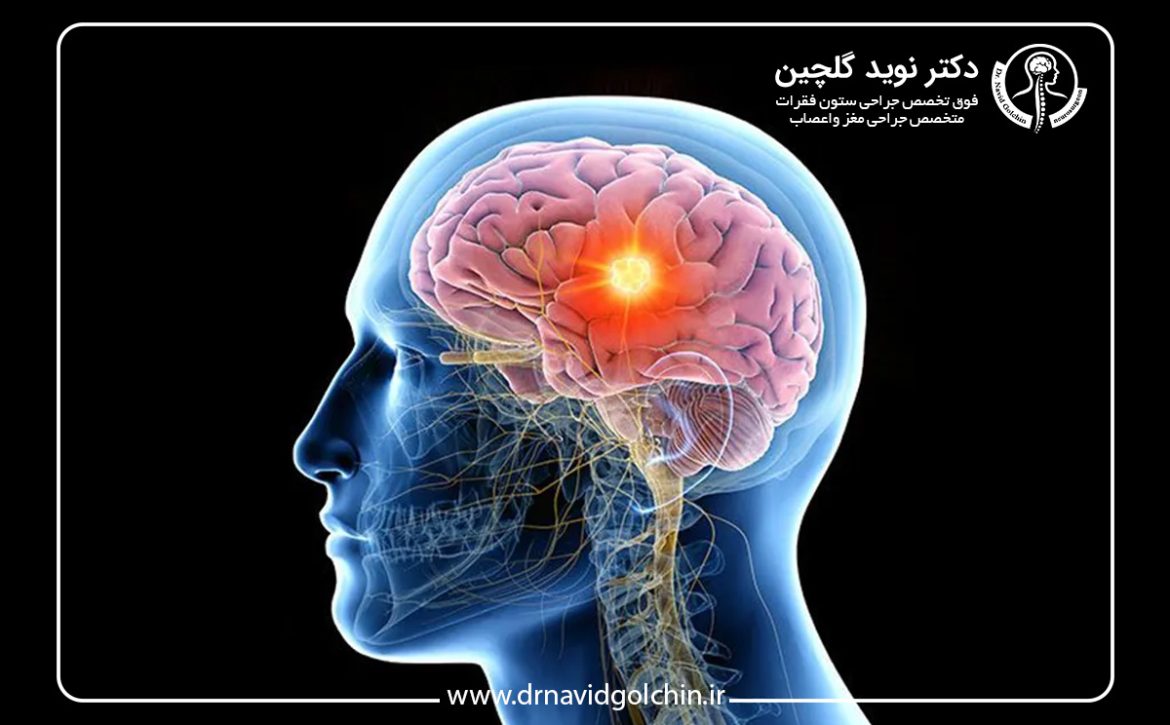
خود بافت مغز فاقد گیرندههای درد است و احساس درد زمانی ایجاد میشود که ساختارهایی مانند پردههای مغزی، عروق خونی یا مسیرهای خاص عصبی تحت فشار یا کشش قرار گیرند. بنابراین، رشد یک تومور در نواحی عمقی مغز ممکن است برای مدت طولانی بدون ایجاد سردرد پیش برود. این موضوع توضیح میدهد که چرا برخی بیماران حتی با تومورهای بزرگ، هیچگونه درد واضحی احساس نمیکنند.
الگوی سردردهای مرتبط با تومور مغزی
در مواردی که سردرد به تومور مغزی مرتبط است، این سردردها معمولاً الگوی مشخص و کلاسیکی ندارند. برخلاف باور رایج، سردرد صبحگاهی یا سردردی که با بیدار شدن از خواب شروع شود، در همه بیماران دیده نمیشود. شدت، زمان بروز و محل سردرد میتواند بسیار متغیر باشد و گاهی شباهت زیادی به میگرن یا سردرد تنشی داشته باشد. همین شباهت باعث میشود سردردهای مرتبط با تومور مغزی در مراحل اولیه بهدرستی تشخیص داده نشوند.
چرا سردرد اغلب اولین علامت نیست؟
بسیاری از تومورهای مغزی بهآرامی رشد میکنند و مغز فرصت تطابق با تغییرات تدریجی را پیدا میکند. در این شرایط، فشار داخل جمجمه بهصورت ناگهانی افزایش نمییابد و در نتیجه سردرد شدید ایجاد نمیشود. به همین دلیل، علائمی مانند تشنج، اختلال گفتار، ضعف اندامها یا تغییرات شناختی ممکن است زودتر از سردرد ظاهر شوند و اولین نشانههای بالینی بیماری باشند.
تمایز سردردهای شایع از سردردهای نگرانکننده
یکی از چالشهای اصلی در بررسی علائم تومور مغزی، تشخیص تفاوت میان سردردهای شایع و سردردهای بالقوه خطرناک است. سردردهایی که سالها با الگوی ثابت وجود داشتهاند، معمولاً نشانه بیماری جدی نیستند. در مقابل، سردردهای جدید، پیشرونده و مقاوم به درمان، بهویژه اگر با علائم عصبی همراه شوند، نیاز به بررسی دقیقتری دارند. با این حال حتی این نوع سردردها نیز در اغلب موارد علل خوشخیمتری دارند.
اهمیت نگاه تصمیممحور به سردرد
در محتوای تصمیممحور، هدف ایجاد تعادل میان آگاهی و آرامش است. تمرکز صرف بر سردرد بهعنوان اولین علامت تومور مغزی میتواند منجر به ترس غیرضروری و مراجعههای مکرر بدون اندیکاسیون پزشکی شود. در مقابل، نادیده گرفتن تغییرات مهم در الگوی سردرد یا همراهی آن با علائم عصبی نیز میتواند خطرناک باشد. تصمیم درست زمانی گرفته میشود که سردرد در کنار سایر نشانهها و سابقه فرد ارزیابی شود.
جمعبندی علمی بخش اول
بر اساس شواهد معتبر، سردرد شدید میتواند یکی از علائم تومور مغزی باشد، اما در اغلب موارد اولین علامت نیست و حتی ممکن است اصلاً وجود نداشته باشد. درک این واقعیت به کاهش ترس از تومور مغزی کمک میکند و مسیر تصمیمگیری آگاهانهتری را برای بیماران و خانوادهها فراهم میسازد. تمرکز بر مجموعه علائم، نه یک نشانه منفرد، کلید تشخیص بهموقع و منطقی در مواجهه با علائم تومور مغزی است.
بخش دوم: سردردهای خطرناک چه تفاوتی با سردردهای معمولی دارند؟
شناخت انواع سردردها: خوشخیم یا نگرانکننده
سردرد یکی از شایعترین مشکلات نورولوژیک است و اغلب مردم حداقل یک بار در زندگی آن را تجربه کردهاند. از نظر بالینی، سردردها به دو دسته کلی تقسیم میشوند: سردردهای اولیه و سردردهای ثانویه. سردردهای اولیه شامل میگرن، سردرد تنشی و سردردهای خوشهای هستند که معمولاً منشأ عصبی دارند و خطرناک محسوب نمیشوند. در مقابل، سردردهای ثانویه ناشی از بیماریهای زمینهای هستند که میتوانند علامت هشداردهندهای از اختلالات جدی مانند تومور مغزی، خونریزی مغزی یا عفونتهای مغزی باشند. تمایز میان این دو نوع سردرد، کلید شناسایی علائم تومور مغزی و جلوگیری از تشخیص دیرهنگام است.
ویژگیهای سردردهای اولیه و خوشخیم
سردردهای اولیه معمولاً دارای ویژگیهای مشخصی هستند:
- میگرن: درد تپنده یک طرفه، تشدید با فعالیت فیزیکی، همراه با تهوع، حساسیت به نور و صدا.
- سردرد تنشی: درد فشاری یا حس سنگینی در دو طرف سر، بدون علائم عصبی، اغلب مرتبط با استرس یا خستگی.
- سردرد خوشهای: درد شدید و متمرکز در اطراف چشم یا گیجگاه، همراه با اشکریزی یا گرفتگی بینی.
این سردردها معمولاً الگوی مشخص و تکرارشونده دارند و با درمانهای استاندارد قابل کنترل هستند.
ویژگیهای سردردهای ثانویه و نگرانکننده
در مقابل، سردردهای ثانویه که ممکن است ناشی از تومور مغزی باشند، دارای ویژگیهای هشداردهندهای هستند:
- شروع ناگهانی یا تدریجی اما پیشرونده
- تغییر در الگوی سابق سردرد یا شدت غیرمعمول
- بیدار کردن فرد از خواب یا شدت گرفتن در ساعات صبح
- همراهی با علائم عصبی دیگر مانند ضعف اندام، تشنج، اختلال بینایی یا گفتار
- عدم پاسخ به درمانهای رایج یا تداوم طولانی مدت
این ویژگیها نشان میدهند که منشأ سردرد ممکن است چیزی فراتر از یک اختلال خوشخیم باشد و نیاز به بررسی تخصصی دارد.
چرا سردرد همیشه با تومور مغزی همراه نیست؟
بسیاری از افراد تصور میکنند هر سردرد شدید، بخصوص در صبح، نشانه تومور مغزی است. این باور ناشی از تفسیر نادرست اطلاعات عمومی و گزارشهای رسانهای است. در واقع، خود بافت مغز گیرنده درد ندارد و درد معمولاً زمانی ایجاد میشود که فشار بر ساختارهای حساس به درد مانند پردههای مغزی یا عروق وارد شود. بنابراین تومورهایی که در مناطق عمیق مغز رشد میکنند، ممکن است حتی در مراحل پیشرفته هیچ درد قابل توجهی ایجاد نکنند.
الگوی تغییر الگوی سردرد: نشانه هشدار
یکی از مهمترین شاخصها برای تشخیص سردرد خطرناک، تغییر الگوی سردرد قبلی است. اگر فردی سابقه میگرن یا سردرد تنشی دارد و ناگهان سردردی متفاوت، شدیدتر یا طولانیتر تجربه میکند، این تغییر میتواند زنگ هشداری برای بررسی دقیقتر باشد. در این شرایط، بررسیهای تصویربرداری مانند MRI یا CT scan ممکن است ضرورت پیدا کنند.
سردردهای مقاوم به درمان و اهمیت آنها
سردردی که به داروهای معمول پاسخ نمیدهد، باید جدی گرفته شود. مقاومت سردرد به درمان، خصوصاً وقتی با علائم عصبی دیگر همراه باشد، میتواند نشانهای از فشار بر مغز یا تومور باشد. این موضوع اهمیت تشخیص زودهنگام را دوچندان میکند و نشان میدهد که تمرکز صرف بر شدت سردرد کافی نیست؛ بلکه باید الگو، محل و ویژگیهای همراه آن نیز ارزیابی شوند.
نقش سایر علائم در تشخیص سردرد خطرناک
سردرد تنها یک علامت است و بررسی سایر علائم همزمان اهمیت بالایی دارد:
- تشنج جدید: حتی اگر سردرد وجود نداشته باشد، تشنج میتواند نشانه فشار یا تومور باشد.
- اختلالات بینایی: تاری دید، دوبینی یا کاهش تدریجی بینایی همراه با سردرد، هشداردهنده است.
- ضعف و بیحسی اندامها: ضعف یکطرفه یا بیحسی اندام میتواند اولین علامت در غیاب سردرد باشد.
- تغییرات شناختی یا رفتاری: کاهش تمرکز، فراموشی یا تغییرات شخصیتی ممکن است همراه یا حتی قبل از سردرد ظاهر شوند.
این رویکرد جامع، مبنای تصمیمگیری دقیق بالینی است و کمک میکند از ترس غیرضروری جلوگیری شود.
تشخیص و ارزیابی بالینی سردرد خطرناک
پزشکان معمولاً برای ارزیابی سردردهای بالقوه خطرناک، پرسشهای مشخصی میپرسند و اقدامات زیر را انجام میدهند:
- بررسی سابقه بیماری و الگوی سردرد
- معاینه نورولوژیک کامل
- تصویربرداری مغزی در صورت وجود علائم هشدار
- آزمایشهای تکمیلی برای رد علل ثانویه
این رویکرد مرحلهای، تضمین میکند که موارد واقعی تومور مغزی بهموقع شناسایی شوند و از انجام آزمایشهای غیرضروری جلوگیری شود.
جمعبندی علمی بخش دوم
سردردهای خطرناک با سردردهای معمولی تفاوتهای کلیدی دارند که درک آنها برای تشخیص به موقع و تصمیمگیری صحیح ضروری است. توجه به الگوی سردرد، ویژگیهای همراه و علائم عصبی همزمان، بهترین راهکار برای تمایز میان علائم خوشخیم و خطرناک محسوب میشود. تمرکز صرف بر شدت یا محل درد بدون بررسی کامل زمینه بالینی میتواند باعث تشخیص دیرهنگام یا اضطراب غیرضروری شود. رویکرد علمی و جامع به سردرد، هم بیماران را آرام میکند و هم به پزشکان امکان میدهد تصمیمات مبتنی بر شواهد و امنیت بالینی اتخاذ کنند.
بخش سوم: علائم پنهان تومور مغزی که اغلب نادیده گرفته میشوند
علائم غیرکلاسیک و اهمیت آنها
بسیاری از بیماران و حتی پزشکان عمومی تصور میکنند که سردرد شدید اولین و شایعترین علامت تومور مغزی است. در حالی که شواهد بالینی نشان میدهند که طیف گستردهای از علائم غیرکلاسیک ممکن است اولین نشانه باشند و بهراحتی نادیده گرفته شوند. این علائم شامل تغییرات بینایی، ضعف اندامها، تشنج و تغییرات رفتاری است. توجه به این علائم پنهان، به ویژه در بیماران بدون سابقه سردرد شدید، میتواند نقش حیاتی در تشخیص زودهنگام داشته باشد.
اختلالات بینایی: اولین هشدار خاموش
تومورهایی که در نواحی نزدیک مسیرهای بینایی یا لوب اکسیپیتال مغز قرار دارند، اغلب باعث تغییرات دیداری میشوند. علائم معمول عبارتند از:
- تاری دید تدریجی
- دوبینی یا دید ناقص در یک طرف
- کاهش میدان دید
این اختلالات میتوانند بدون هیچ سردردی ظاهر شوند و اولین نشانه فشار یا درگیری مغز باشند. بسیاری از بیماران تغییرات بینایی را به خستگی چشم یا مشکلات عادی بینایی نسبت میدهند، در حالی که ممکن است به تومور مغزی مرتبط باشد.
تشنجهای جدید در بزرگسالان
بروز تشنج برای اولین بار در بزرگسالان یک علامت هشداردهنده مهم است، حتی اگر سردرد وجود نداشته باشد. تشنج ممکن است شامل لرزش اندامها، بیحسی یا تغییر در هوشیاری باشد. مطالعات نشان دادهاند که در برخی بیماران، تشنج اولین علامت تومور مغزی بوده و تشخیص بیماری را امکانپذیر کرده است.
ضعف و بیحسی اندامها
تومورهایی که لوبهای حرکتی یا حسی را درگیر میکنند، میتوانند باعث ضعف یکطرفه اندامها، بیحسی یا کاهش هماهنگی حرکتی شوند. این علائم اغلب تدریجی ظاهر میشوند و ممکن است ابتدا به مشکلات عضلانی، آسیبهای ورزشی یا اختلالات عصب محیطی نسبت داده شوند، در حالی که منشأ مغزی دارند.
تغییرات شناختی و حافظه
تومورهای لوب فرونتال و لوب تمپورال مغز میتوانند باعث اختلالات شناختی شوند. علائم شایع شامل:
- کاهش تمرکز و توجه
- فراموشی کوتاهمدت
- اختلال در برنامهریزی یا حل مسئله
این تغییرات اغلب آهسته و تدریجی هستند و خانواده یا خود بیمار ممکن است آنها را به استرس یا سن نسبت دهند، در حالی که این علائم میتوانند نشانهای از رشد تومور باشند.
تغییرات رفتاری و شخصیتی
برخی بیماران تغییرات رفتاری مانند بیتفاوتی، تحریکپذیری، افسردگی ناگهانی یا کاهش انگیزه را تجربه میکنند. این علائم اغلب به مشکلات روانی نسبت داده میشوند و بهراحتی نادیده گرفته میشوند، در حالی که میتوانند ناشی از فشار تومور بر نواحی لوب فرونتال باشند.
استفراغ و اختلالات تعادلی
در برخی تومورهای مغز، به ویژه در کودکان، استفراغ، سرگیجه و مشکلات تعادلی ممکن است شایع باشند. مطالعات نشان دادهاند که در بیش از نیمی از کودکان مبتلا به تومور مغزی، این علائم قبل از هر سردردی ظاهر شدهاند. توجه به این نشانهها میتواند موجب تشخیص به موقع شود.
علائم پنهان و اهمیت تصویربرداری
با توجه به متنوع بودن علائم پنهان، استفاده از روشهای تصویربرداری مانند MRI یا CT scan در بیماران با علائم هشداردهنده اما بدون سردرد شدید، اهمیت ویژهای دارد. این ابزارها میتوانند تومورهای کوچک یا در حال رشد را شناسایی کنند و از پیشرفت بیماری جلوگیری کنند.
نقش ارزیابی بالینی جامع
پزشکان متخصص نورولوژی و نوروانکولوژی همیشه توصیه میکنند که ارزیابی بالینی جامع شامل تاریخچه دقیق پزشکی، معاینه عصبی کامل و بررسی علائم غیرکلاسیک انجام شود. این رویکرد مرحلهای باعث میشود که حتی در غیاب سردرد، تومورهای مغزی به موقع تشخیص داده شوند.
جمعبندی علمی بخش سوم
علائم پنهان تومور مغزی میتوانند شامل تغییرات بینایی، تشنج، ضعف اندامها، اختلالات شناختی، تغییرات رفتاری و مشکلات تعادلی باشند. شناسایی این علائم قبل از بروز سردرد شدید، کلید تشخیص به موقع و افزایش موفقیت درمان است. توجه به الگوی تدریجی و غیرکلاسیک علائم، به همراه تصویربرداری و بررسی بالینی دقیق، میتواند از تشخیص دیرهنگام جلوگیری کند و اضطراب بیماران را کاهش دهد. رویکرد علمی و جامع به علائم پنهان، به خواننده کمک میکند تا ترس غیرضروری را کنار گذاشته و تصمیمهای آگاهانه و منطقی در مواجهه با نشانههای مغزی بگیرد.
بخش چهارم: تومور مغزی بدون سردرد؛ آیا امکانپذیر است؟
آیا تومور مغزی همیشه با درد همراه است؟
یک باور رایج در میان عموم مردم و حتی برخی پزشکان این است که هر تومور مغزی با سردرد شدید و مداوم شروع میشود. با این حال، شواهد بالینی و مطالعات موردی نشان میدهند که بسیاری از بیماران ممکن است در مراحل اولیه هیچ سردردی تجربه نکنند. تومور مغزی بدون سردرد نه تنها امکانپذیر است، بلکه نسبت قابل توجهی از بیماران را شامل میشود.
دلایل عدم بروز سردرد در بیماران
چندین عامل باعث میشود تومور در مراحل اولیه بدون درد باشد:
- محل تومور: تومورهایی که در لوبهای عمقی مغز یا نواحی غیرحساس به درد رشد میکنند، فشار کافی برای تحریک درد ایجاد نمیکنند.
- رشد آهسته: تومورهای با رشد تدریجی، فرصت سازگاری مغز با فشار افزایشی را فراهم میکنند و سردرد ناگهانی ایجاد نمیشود.
- فشار محدود: تومورهای کوچک یا محدود به یک ناحیه خاص ممکن است علائم عصبی مختصر ایجاد کنند اما هنوز ساختارهای حساس به درد را تحریک نکنند.
این دلایل علمی توضیح میدهند که چرا بیماران ممکن است با علائم غیرکلاسیک مراجعه کنند و بدون سردرد، تشخیص داده شوند.
علائم جایگزین در غیاب سردرد
در بسیاری از بیماران بدون سردرد، علائم دیگری به عنوان اولین نشانه ظاهر میشوند:
- تشنج: اغلب اولین علامت در بزرگسالان است و ممکن است به شکل لرزش اندامها یا تغییر هوشیاری رخ دهد.
- اختلال بینایی: تاری دید، کاهش میدان دید یا دوبینی میتواند اولین نشانه فشار یا درگیری مغز باشد.
- ضعف یا بیحسی اندامها: کاهش هماهنگی یا ضعف یک طرف بدن ممکن است به تومور لوب حرکتی مربوط باشد.
- تغییرات رفتاری و شناختی: کاهش تمرکز، فراموشی کوتاهمدت، بیتفاوتی یا تغییر شخصیت، بدون سردرد قابل مشاهده است.
این علائم نشان میدهند که سردرد لزوماً معیار اصلی برای تشخیص تومور نیست و ارزیابی جامع بالینی حیاتی است.
مطالعات بالینی و شواهد علمی
مطالعه مقطعی روی ۱۷۱ بیمار با تومور مغزی نشان داد که ۷۱٪ بیماران سردرد داشتند، اما شدت، نوع و موقعیت آن بسیار متغیر بود و در ۲۹٪ بیماران سردرد اصلاً وجود نداشت. همچنین مطالعه روی ۱۱۱ بیمار نشان داد که تنها نیمی از بیماران دچار سردرد بودند و الگوی کلاسیک سردرد صبحگاهی بسیار نادر بود. این یافتهها تأکید میکنند که غیاب سردرد به معنی عدم وجود تومور نیست و باید سایر علائم را با دقت بررسی کرد.
گزارشهای موردی از بیماران بدون سردرد
در یکی از گزارشهای موردی، کودک مبتلا به تومور مغزی نه تنها سردرد نداشت، بلکه علائم غیرکلاسیک مانند دردهای عضلانی و مشکلات رفتاری باعث انجام MRI و تشخیص تومور شد. این نمونهها نشان میدهند که بررسی علائم پنهان و غیرکلاسیک میتواند تشخیص زودهنگام را ممکن سازد، حتی در غیاب سردرد.
اهمیت تصویربرداری و ارزیابی جامع
برای بیمارانی که بدون سردرد به پزشک مراجعه میکنند اما علائم عصبی غیرکلاسیک دارند، تصویربرداری مغزی نقش حیاتی دارد. MRI و CT scan به تشخیص تومورهای کوچک یا عمیق کمک میکنند و از پیشرفت بیماری جلوگیری میکنند. همچنین معاینه نورولوژیک جامع، بررسی حافظه، تمرکز، بینایی و حرکت اندامها، بخش مهمی از ارزیابی بالینی است.
رویکرد تصمیممحور در مواجهه با غیاب سردرد
در محتوا و نگاه تصمیممحور، بیماران باید بدانند که غیاب سردرد به معنای سلامت کامل مغز نیست. ارزیابی مجموعه علائم، درک تغییرات رفتاری و شناختی، و توجه به اختلالات عصبی جزئی، راهنمای تصمیمگیری آگاهانه است. این رویکرد به بیماران کمک میکند بدون ترس غیرضروری یا اضطراب شدید، اقدامات مناسب پزشکی را انجام دهند.
جمعبندی علمی بخش چهارم
تومور مغزی بدون سردرد یک پدیده شایع و کاملاً ممکن است. محل تومور، رشد آهسته و فشار محدود میتوانند باعث عدم بروز درد شوند. بنابراین تمرکز صرف بر سردرد برای تشخیص تومور مغزی کافی نیست و باید سایر علائم عصبی، شناختی و رفتاری نیز مورد توجه قرار گیرند. شواهد علمی و گزارشهای بالینی نشان میدهند که بررسی جامع، همراه با تصویربرداری مناسب، کلید تشخیص زودهنگام و تصمیمگیری منطقی است.
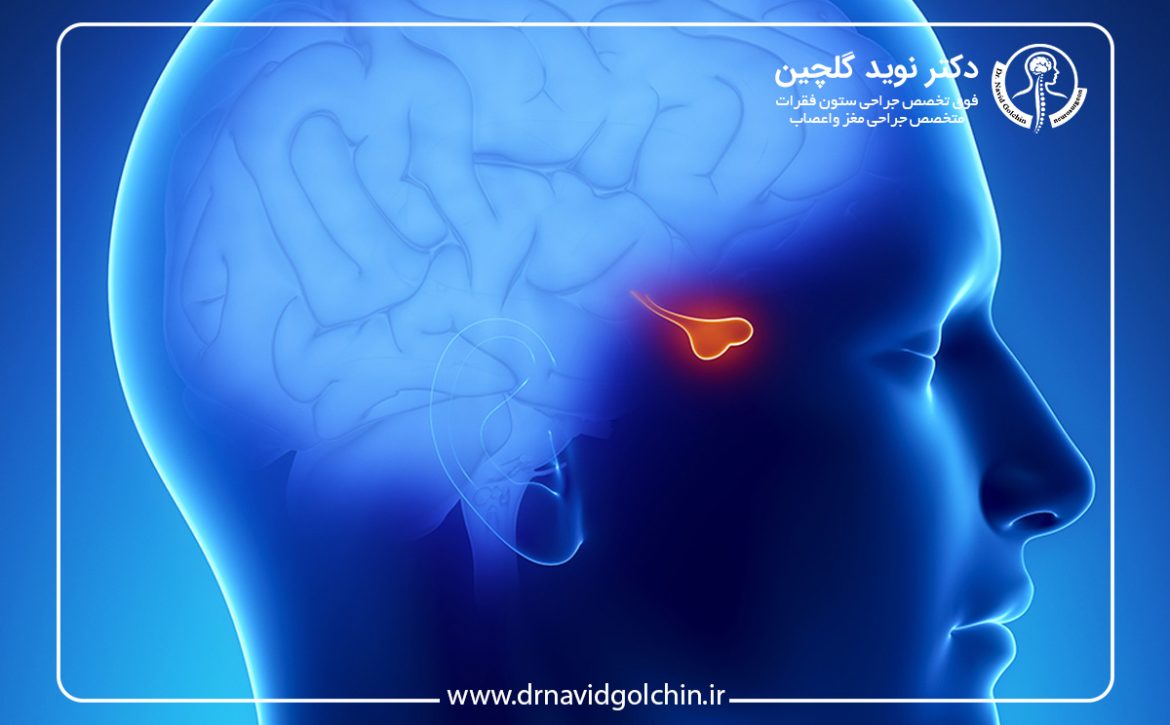
بخش پنجم: نقش محل تومور در بروز علائم عصبی
چرا محل تومور اهمیت دارد؟
یکی از عوامل کلیدی که تعیین میکند چه علائمی در بیماران مبتلا به تومور مغزی ظاهر میشود، محل دقیق رشد تومور است. مغز انسان به بخشهای مختلفی تقسیم شده است که هر کدام مسئول عملکردهای خاصی هستند، از حرکت و حس تا تفکر و حافظه. بنابراین، تومورهایی که هر بخش را درگیر میکنند، میتوانند علائم متفاوتی ایجاد کنند. درک این ارتباط بین محل تومور و علائم عصبی، به پزشکان و بیماران کمک میکند تا تشخیص به موقع و تصمیمگیری آگاهانه داشته باشند.
تومورهای لوب پیشانی و تغییرات شناختی
لوب پیشانی مغز مسئول تصمیمگیری، برنامهریزی، رفتار اجتماعی و کنترل هیجانات است. تومور در این ناحیه میتواند علائم زیر را ایجاد کند:
- تغییرات شخصیتی و رفتاری
- کاهش تمرکز و توجه
- مشکلات در برنامهریزی و حل مسئله
- بیتفاوتی یا تحریکپذیری
این علائم معمولاً تدریجی ظاهر میشوند و ممکن است ابتدا به مشکلات روانی یا خستگی نسبت داده شوند، در حالی که نشانه فشار یا درگیری لوب پیشانی توسط تومور هستند.
تومورهای لوب تمپورال و اختلالات حافظه
لوب تمپورال مسئول پردازش حافظه، زبان و احساسات است. تومورهای این ناحیه ممکن است باعث علائم زیر شوند:
- فراموشی کوتاهمدت یا مشکلات حافظه
- اختلالات گفتاری یا فهم زبان
- تشنجهای جزئی که ممکن است ابتدا نادیده گرفته شوند
این علائم غیرکلاسیک میتوانند بدون سردرد شدید ظاهر شوند و تشخیص را چالشبرانگیز کنند.
تومورهای لوب پاریتال و مشکلات حسی-حرکتی
لوب پاریتال مسئول پردازش حسها و حرکتهای بدن است. تومور در این منطقه میتواند باعث:
- بیحسی یا ضعف اندامها
- مشکلات هماهنگی حرکتی
- کاهش توانایی در تشخیص موقعیت یا لمس
این علائم اغلب تدریجی و نامحسوس هستند و بیماران ممکن است آنها را به مشکلات عضلانی یا آسیبهای جزئی نسبت دهند، در حالی که منشأ مغزی دارند.
تومورهای لوب اکسیپیتال و اختلال بینایی
لوب اکسیپیتال مسئول بینایی است. تومورهایی که این ناحیه را درگیر میکنند، میتوانند باعث اختلالات بینایی زیر شوند:
- کاهش میدان دید
- دوبینی یا تاری دید
- مشکل در تشخیص رنگها یا اشیاء
این علائم ممکن است بدون سردرد باشند و تنها از طریق بررسی بینایی یا تصویربرداری مغزی شناسایی شوند.
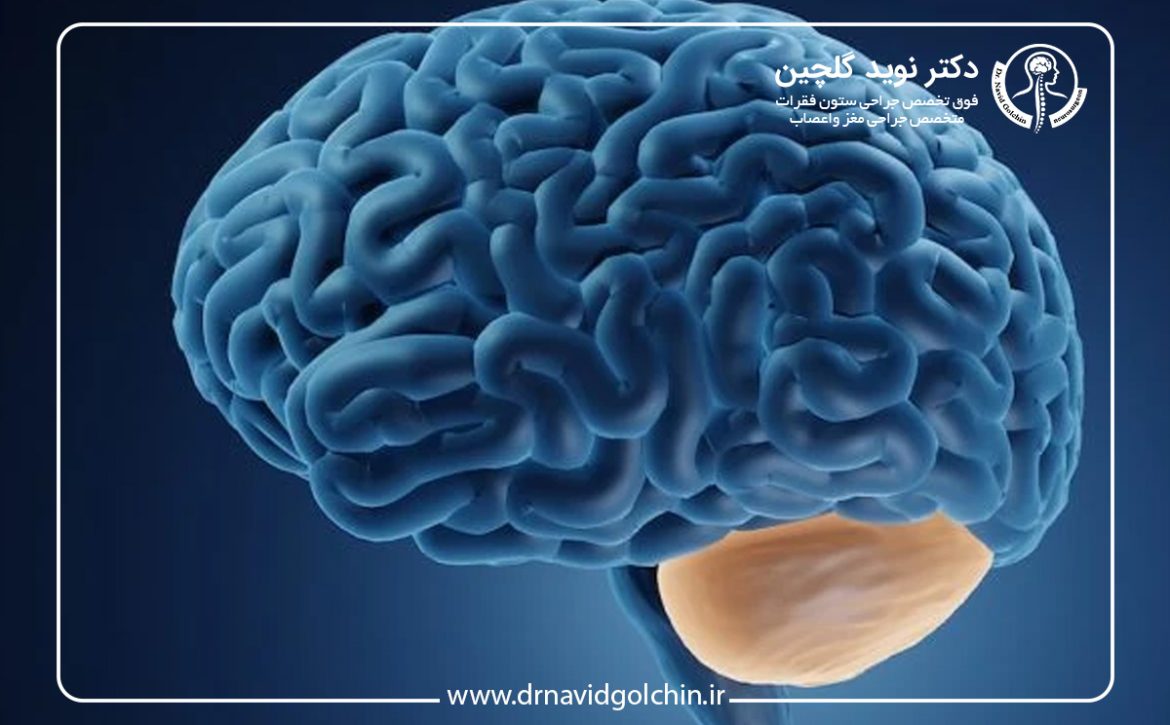
تومورهای مخچه و اختلال تعادل
مخچه مسئول هماهنگی حرکتی و تعادل است. تومور در این ناحیه میتواند باعث:
- سرگیجه و مشکلات تعادلی
- اختلال در راه رفتن یا حرکات دقیق
- حالت تهوع و استفراغ
این علائم بهویژه در کودکان شایع است و ممکن است بدون سردرد شدید ظاهر شود.
تومورهای ساقه مغز و علائم حیاتی
ساقه مغز کنترل عملکردهای حیاتی مانند تنفس، ضربان قلب و بلع را بر عهده دارد. تومور در این ناحیه میتواند باعث علائم خطرناکی مانند:
- اختلال در بلع و صحبت کردن
- تغییرات در ریتم تنفس
- ضعف عمومی یا فلج اندامها
این نشانهها به سرعت تشخیص را ضروری میکنند و معمولاً با سردرد شدید همراه نیستند.
اهمیت تشخیص بر اساس محل تومور
شناخت ارتباط بین محل تومور و علائم عصبی به پزشکان امکان میدهد تا:
- تصویربرداری هدفمند انجام دهند
- ارزیابی بالینی دقیقتری داشته باشند
- درمان مناسب و زمانبندی شده را برنامهریزی کنند
این رویکرد باعث کاهش تشخیص دیرهنگام و افزایش موفقیت درمان میشود.
جمعبندی علمی بخش پنجم
محل تومور مغزی نقش تعیینکنندهای در نوع علائم عصبی دارد. هر لوب و ناحیه مغز عملکردهای خاص خود را دارد و درگیری هر بخش، مجموعه متفاوتی از علائم پنهان یا آشکار ایجاد میکند. از تغییرات شناختی و رفتاری تا اختلالات حرکتی، بینایی و تعادل، شناخت محل تومور به تشخیص به موقع و تصمیمگیری علمی کمک میکند. توجه به این ارتباط، هم بیماران را آگاه میسازد و هم مسیر درمانی دقیقتری برای پزشکان فراهم میکند.
بخش ششم: تغییرات رفتاری و شناختی؛ زنگ خطر خاموش
چرا تغییرات رفتاری و شناختی اهمیت دارند؟
یکی از مهمترین و در عین حال کمتر شناختهشدهترین علائم تومور مغزی، تغییرات رفتاری و شناختی است. این علائم اغلب تدریجی و غیرکلاسیک ظاهر میشوند و بیماران یا خانوادهها ممکن است آنها را به استرس، خستگی یا سن نسبت دهند. شناسایی به موقع این نشانهها میتواند زنگ خطری برای بررسی دقیق مغز و تشخیص زودهنگام باشد.
اختلالات شناختی: نشانههای غیرمشهود
اختلالات شناختی در بیماران مبتلا به تومور مغزی شامل تغییرات در تواناییهای ذهنی و پردازش اطلاعات است. شایعترین علائم عبارتند از:
- کاهش تمرکز و توجه در انجام فعالیتهای روزمره
- فراموشی کوتاهمدت و دشواری در یادآوری اطلاعات جدید
- مشکلات در برنامهریزی، سازماندهی و حل مسئله
این علائم معمولاً قبل از بروز علائم فیزیکی مانند سردرد ظاهر میشوند و میتوانند اولین نشانه فشار یا درگیری لوب پیشانی و تمپورال باشند.
تغییرات رفتاری و شخصیتی
تومورهای لوب پیشانی و سایر نواحی مرتبط با رفتار و هیجان، میتوانند تغییرات رفتاری ایجاد کنند که اغلب نادیده گرفته میشوند:
- بیتفاوتی نسبت به فعالیتهای روزمره
- تحریکپذیری یا افسردگی ناگهانی
- کاهش انگیزه و انرژی برای انجام کارهای معمول
- تغییر در تعاملات اجتماعی و تصمیمگیری
این تغییرات میتوانند خانواده و اطرافیان را نگران کنند، اما اغلب به مشکلات روانی یا استرس نسبت داده میشوند. تشخیص دقیق نیازمند بررسی نورولوژیک و تصویربرداری است.
ارتباط بین تغییرات شناختی و محل تومور
محل تومور نقش کلیدی در نوع اختلال شناختی و رفتاری دارد:
- لوب پیشانی: مشکلات در تصمیمگیری، برنامهریزی و رفتار اجتماعی
- لوب تمپورال: اختلال در حافظه و درک زبان
- لوب پاریتال: دشواری در تشخیص موقعیت و هماهنگی حرکتی
شناخت این ارتباط به پزشکان کمک میکند تا تصویربرداری هدفمند انجام دهند و علائم را دقیقتر تفسیر کنند.
چگونه خانوادهها میتوانند علائم را تشخیص دهند؟
تغییرات رفتاری و شناختی ممکن است تدریجی ظاهر شوند، اما نشانههایی وجود دارند که خانوادهها باید به آنها توجه کنند:
- فراموشیهای مکرر یا کاهش توانایی در انجام کارهای روزمره
- رفتارهای غیرمعمول یا تغییر ناگهانی در شخصیت
- کاهش علاقه به فعالیتهای اجتماعی یا سرگرمیها
- دشواری در تصمیمگیری حتی در مسائل ساده
شناسایی این علائم و مراجعه به پزشک متخصص نورولوژی یا نوروانکولوژی میتواند موجب تشخیص زودهنگام شود.
اهمیت ارزیابی روانشناختی و نورولوژیک
برای بیماران مبتلا به تغییرات شناختی یا رفتاری، ارزیابی روانشناختی و نورولوژیک ضروری است. این ارزیابی شامل:
- بررسی دقیق حافظه، تمرکز و تواناییهای شناختی
- معاینه عصبی برای شناسایی ضعفها یا اختلالات حسی-حرکتی
- تصویربرداری مغزی با MRI یا CT scan برای شناسایی تومور
این رویکرد جامع کمک میکند که تغییرات رفتاری و شناختی به عنوان زنگ خطر خاموش شناسایی شوند و از تشخیص دیرهنگام جلوگیری شود.
جمعبندی علمی بخش ششم
تغییرات رفتاری و شناختی میتوانند اولین علامت تومور مغزی باشند، حتی در غیاب سردرد یا علائم فیزیکی دیگر. این علائم شامل کاهش تمرکز، فراموشی کوتاهمدت، بیتفاوتی، تحریکپذیری و تغییر شخصیت هستند و ارتباط مستقیم با محل تومور دارند. شناسایی به موقع این نشانهها، ارزیابی جامع بالینی و تصویربرداری هدفمند، مسیر تشخیص دقیق و درمان موفق را هم برای بیماران و هم برای پزشکان فراهم میکند. توجه به این زنگ خطر خاموش، از اضطراب غیرضروری جلوگیری کرده و امکان تصمیمگیری علمی و آگاهانه را فراهم میآورد.
بخش هفتم: چه زمانی باید برای بررسی تومور مغزی به پزشک مراجعه کرد؟
اهمیت اقدام به موقع
تشخیص زودهنگام تومور مغزی کلید موفقیت در درمان و کاهش عوارض است. بسیاری از بیماران به دلیل باور اشتباه که «فقط سردرد شدید نشانه تومور است»، علائم دیگر را نادیده میگیرند. شناخت زمان مناسب برای مراجعه به پزشک، میتواند از پیشرفت بیماری جلوگیری کند و تصمیمگیریهای درمانی را بهینه کند.
علائم هشداردهنده که نیازمند مراجعه فوری هستند
برخی نشانهها نشان میدهند که لازم است بیمار فوراً با متخصص نورولوژی یا نوروانکولوژی مشورت کند:
- سردرد جدید و شدید: به ویژه اگر تغییر الگو یا شدت آن نسبت به گذشته داشته باشد
- تشنج ناگهانی: حتی اگر قبلاً سابقه تشنج نداشتهاید
- ضعف یا بیحسی اندامها: کاهش توان حرکتی یا بیحسی یک طرف بدن
- تغییرات بینایی: تاری، دوبینی یا کاهش میدان دید
- اختلالات تعادلی یا سرگیجه شدید: همراه با حالت تهوع یا استفراغ
- تغییرات رفتاری و شناختی: فراموشی، بیتفاوتی یا تحریکپذیری غیرمعمول
این علائم، حتی بدون سردرد شدید، میتوانند نشانهای از فشار یا درگیری مغز باشند و نیازمند بررسی دقیق و تصویربرداری هستند.
چه اقداماتی قبل از مراجعه میتوان انجام داد؟
قبل از مراجعه به پزشک، جمعآوری اطلاعات دقیق درباره علائم و تاریخچه آنها میتواند به تشخیص کمک کند:
- یادداشت دقیق الگو، شدت و مدت زمان علائم
- ثبت تغییرات رفتاری، شناختی و حرکتی
- مستندسازی عوامل محرک یا تسکیندهنده علائم
این اطلاعات به پزشک کمک میکند که ارزیابی دقیقتری انجام دهد و تصویربرداری هدفمند را برنامهریزی کند.
اقدامات تشخیصی رایج توسط پزشک
پزشک معمولاً بر اساس علائم بیمار، اقدامات زیر را پیشنهاد میکند:
- معاینه عصبی کامل: بررسی قدرت، حس، تعادل و رفلکسها
- ارزیابی شناختی و روانشناختی: بررسی حافظه، توجه، رفتار و تصمیمگیری
- تصویربرداری مغزی: MRI بهترین گزینه برای شناسایی تومورهای کوچک یا عمیق است، CT scan نیز برای تشخیص سریع مورد استفاده قرار میگیرد
- آزمایشهای تکمیلی: در برخی موارد، آزمایشهای خون یا بیوپسی برای تأیید نوع تومور
این رویکرد مرحلهای، تشخیص دقیق و تصمیمگیری درمانی مؤثر را امکانپذیر میکند.
چه عواملی باعث تأخیر در مراجعه میشوند؟
برخی بیماران به دلیل ترس یا باورهای غلط، مراجعه به پزشک را به تأخیر میاندازند:
- تصور اینکه فقط سردرد شدید یا مداوم نشانه تومور است
- نسبت دادن تغییرات شناختی یا رفتاری به استرس یا سن
- ترس از تصویربرداری یا نتایج آزمایشها
آگاهی از اینکه بسیاری از تومورهای مغزی میتوانند بدون سردرد و با علائم پنهان ظاهر شوند، میتواند مانع از تأخیر و افزایش احتمال تشخیص به موقع شود.
رویکرد تصمیممحور برای بیماران
رویکرد Decision محور به بیماران کمک میکند تا اقدامات آگاهانه و منطقی انجام دهند:
- شناسایی و ثبت علائم هشداردهنده
- مشورت با پزشک متخصص در اسرع وقت
- انجام تصویربرداری و بررسیهای بالینی کامل
- ارزیابی نتیجه و برنامهریزی درمان بر اساس تشخیص دقیق
این روند علمی و مرحلهای باعث کاهش اضطراب و ترس غیرضروری بیماران میشود و امکان انتخاب بهترین مسیر درمانی را فراهم میکند.
جمعبندی علمی بخش هفتم
مراجعه به پزشک هنگام مشاهده علائم هشداردهنده، حتی بدون سردرد شدید، ضروری است. علائم مانند تشنج، ضعف اندامها، اختلالات بینایی، تغییرات رفتاری یا تعادلی نباید نادیده گرفته شوند. جمعآوری دقیق اطلاعات علائم، انجام معاینه عصبی و شناختی، تصویربرداری هدفمند و پیگیری دقیق نتایج، مسیر تشخیص زودهنگام و تصمیمگیری علمی را برای بیماران فراهم میکند. آگاهی و اقدام به موقع، کلید کاهش عوارض و بهبود موفقیت درمان تومور مغزی است.
بخش هشتم: باورهای غلط رایج درباره تومور مغزی و سردرد
باور غلط ۱: هر سردرد شدید نشانه تومور مغزی است
یکی از شایعترین اشتباهات این است که مردم تصور میکنند هر سردرد شدید، مخصوصاً صبحگاهی، نشانه تومور مغزی است. در واقع، مطالعات نشان دادهاند که تنها حدود نیمی از بیماران مبتلا به تومور مغزی، سردرد را تجربه میکنند و الگوی کلاسیک سردرد صبحگاهی بسیار نادر است. بسیاری از سردردها ناشی از میگرن، تنش یا مشکلات عروقی هستند و نباید هر سردرد را با ترس از تومور مغزی مرتبط دانست.
باور غلط ۲: تومور مغزی همیشه علائم واضح و فوری ایجاد میکند
برخی معتقدند که تومورهای مغزی به سرعت باعث بروز علائم شدید میشوند. در واقع، بسیاری از تومورها به تدریج رشد میکنند و علائم اولیه آنها ممکن است غیرکلاسیک، خفیف یا تدریجی باشد، از جمله تغییرات رفتاری، اختلالات شناختی یا ضعف جزئی اندامها. این باور غلط باعث میشود بیماران و خانوادهها علائم پنهان را نادیده بگیرند.
باور غلط ۳: بدون سردرد، احتمال تومور بسیار کم است
مطالعات متعدد و کیسهای بالینی نشان دادهاند که بیماران بسیاری بدون سردرد، تومور مغزی داشتهاند. بهعنوان مثال، مطالعه مقطعی روی ۱۷۱ بیمار نشان داد که ۲۹٪ بیماران هیچ سردردی نداشتند، اما علائم عصبی دیگری مانند ضعف، تشنج یا تغییرات شناختی داشتند. بنابراین غیاب سردرد به معنای سلامت کامل مغز نیست.
باور غلط ۴: تومور مغزی همیشه باعث مرگ سریع میشود
این باور باعث ایجاد ترس شدید و اضطراب در بیماران میشود. واقعیت این است که نوع، محل و اندازه تومور، سن و وضعیت عمومی بیمار، و درمان به موقع، نقش تعیینکنندهای در پیشآگهی دارند. بسیاری از بیماران با تشخیص زودهنگام و درمان مناسب، کیفیت زندگی طولانی و قابل قبول دارند.
باور غلط ۵: همه تومورها نیازمند جراحی فوری هستند
برخی بیماران تصور میکنند که هر تومور مغزی باید فوراً جراحی شود. در واقع، نوع تومور، محل آن و سرعت رشد تعیینکننده است. برخی تومورها با شیمیدرمانی، پرتو درمانی یا درمانهای ترکیبی قابل کنترل هستند و تصمیم درمانی باید بر اساس تشخیص دقیق و مشورت با نوروانکولوژیست انجام شود.
باور غلط ۶: علائم رفتاری و شناختی به مسائل روانی مربوط هستند، نه مغز
تغییرات تدریجی در حافظه، توجه، رفتار و شخصیت اغلب به استرس یا سن نسبت داده میشوند، اما ممکن است ناشی از فشار یا درگیری مغز توسط تومور باشند. شناخت این باور غلط اهمیت دارد تا بیماران و خانوادهها اقدامات تشخیصی و درمانی مناسب را به تأخیر نیندازند.
چرا اصلاح این باورها مهم است؟
اصلاح این باورهای غلط باعث کاهش اضطراب غیرضروری، افزایش آگاهی و اقدام به موقع میشود. بیماران با درک صحیح علائم و نشانهها، میتوانند تصمیمات علمی و منطقی در مواجهه با تومور مغزی بگیرند و از پیشرفت بیماری جلوگیری کنند.
جمعبندی علمی بخش هشتم
باورهای رایج و غلط درباره تومور مغزی و سردرد میتوانند باعث ترس غیرضروری، تأخیر در تشخیص و تصمیمگیری نادرست شوند. واقعیتهای علمی نشان میدهند که:
- تومور مغزی همیشه با سردرد شروع نمیشود
- علائم پنهان، تدریجی و غیرکلاسیک شایع هستند
- غیاب سردرد، به معنای سلامت کامل مغز نیست
- تشخیص به موقع و ارزیابی جامع بالینی، کلید موفقیت در درمان است
آگاهی و اصلاح این باورهای غلط به بیماران و خانوادهها کمک میکند تا با آرامش، اطلاعات علمی و تصمیمگیری منطقی، مسیر درمانی صحیح را دنبال کنند.
بخش نهم: نتیجهگیری
اهمیت شناخت علائم غیرکلاسیک
شناخت و درک علائم تومور مغزی، بهویژه علائم پنهان و غیرکلاسیک، نقش حیاتی در تشخیص زودهنگام و تصمیمگیری علمی دارد. برخلاف باور رایج، تومور مغزی همیشه با سردرد شدید شروع نمیشود و بسیاری از بیماران ممکن است بدون سردرد، تنها با تغییرات رفتاری، اختلالات شناختی، ضعف اندامها، تشنج یا مشکلات بینایی مراجعه کنند.
تأثیر محل تومور بر نوع علائم
محل تومور در مغز تأثیر مستقیم بر نوع علائم دارد:
- لوب پیشانی: تغییرات رفتاری و تصمیمگیری
- لوب تمپورال: اختلال حافظه و تشنج
- لوب پاریتال و مخچه: مشکلات حرکتی و تعادلی
تغییرات شناختی و رفتاری اغلب بهعنوان زنگ خطر خاموش عمل میکنند و نیازمند توجه دقیق خانواده و پزشکان است.
باورهای غلط رایج
باورهای نادرست مانند «هر سردرد شدید نشانه تومور است» یا «بدون سردرد احتمال تومور بسیار کم است»، میتوانند باعث ترس غیرضروری، تأخیر در مراجعه و تشخیص نادرست شوند. اصلاح این باورها و آگاهی از علائم واقعی، بیماران را قادر میسازد مسیر درمانی مناسب را انتخاب کنند.
راهکارهای تشخیص و پیگیری
- مراجعه به پزشک متخصص هنگام مشاهده علائم هشداردهنده
- انجام تصویربرداری هدفمند
- ارزیابی عصبی و شناختی جامع
- پیگیری منظم
آگاهی، اقدام به موقع و تمرکز بر علائم واقعی، هم آرامش ذهنی بیمار و خانواده را افزایش میدهد و هم نتایج درمانی بهینه را تضمین میکند
برای بررسی علائم هشداردهنده و دریافت مشاوره تخصصی، همین امروز با مطب ما تماس بگیرید و سلامت مغز خود را جدی بگیرید.
بیشتر بخوانید: علائم تومور مغزی
بخش دهم: مطالعات موردی (Case Studies)
در این بخش، نتایج مهمترین مطالعات بالینی و گزارشهای موردی در مورد ارتباط بین علائم تومور مغزی و سردرد یا علائم غیرکلاسیک آورده شده است. این دادهها به تصمیمگیری علمی و آگاهیبخشی به بیماران کمک میکند:
مطالعه روی ۱۱۱ بیمار با تومور مغزی
- در این مطالعهای که بر ۱۱۱ بیمار مبتلا به تومور مغزی انجام شد، مشخص شد که تنها ۴۸٪ بیماران سردرد داشتند.
- همچنین سردرد کلاسیک «سردرد شدید صبحگاهی» که بهعنوان نشانه رایج تومور مغزی شناخته میشود، نادر بود.
- بیشتر سردردها شبیه سردردهای تنشی یا میگرنی بودند و معمولاً همراه با تهوع، استفراغ یا تغییرات عصبی بودند؛ اینها نشانههایی هستند که باید توجه بیشتری به آنها شود.
مطالعه مقطعی روی ۱۷۱ بیمار
- در یک مطالعه مقطعی دیگر، ۷۱٪ بیماران تومور مغزی سردرد داشتند، اما الگو، شدت و ویژگی سردردها بسیار متفاوت بود.
- این تنوع در سردردها نشان میدهد که سردرد بهتنهایی نمیتواند معیار مطمئنی برای تشخیص تومور مغزی باشد و باید در کنار سایر علائم تفسیر شود.
بررسی ۲۰۰ مورد تومور مغزی در کودکان
- در مطالعهای روی کودکان با تومور مغزی، سردرد شایعترین علامت بود، اما در بسیاری از کودکان علائم دیگری نیز دیده شد مانند استفراغ، اختلالات تعادلی، مشکلات بینایی، علائم رفتاری و نشانههای دیگر.
- این یافتهها نشان میدهد که سردرد در کودکان اغلب با علائم دیگر همراه است و وجود فقط سردرد، تومور مغزی را رد یا تأیید نمیکند.
گزارشهای مروری علمی
- مطالعات مروری در مورد سردرد و تومور مغزی نشان دادهاند که حتی در بیماران با تومورهای بزرگ، ممکن است سردرد وجود نداشته باشد و علائمی مانند تشنج، ضعف اندامها یا مشکلات بینایی بهصورت برجستهتر ظاهر شوند. این امر اشتباه گرفتن سردردهای معمولی با علائم تومور مغزی را دشوار میسازد.