آیا سردردهای شدید می توانند نشانه ادم مغزی باشند؟
مقدمه
تعریف سردردهای شدید و اهمیت آنها
سردرد شدید یکی از رایجترین مشکلات عصبی است که تقریباً همه افراد در طول زندگی خود تجربه میکنند. با این حال، برخی سردردها از حالت معمول فراتر میروند و شدت آنها به حدی است که فعالیتهای روزمره را مختل میکند. سردردهای شدید معمولاً با ویژگیهایی مانند شروع ناگهانی، شدت غیرقابل تحمل، و همراهی با تهوع، استفراغ، اختلال بینایی یا تغییرات هوشیاری شناخته میشوند. توجه ویژه به این نوع سردردها اهمیت بالایی دارد، زیرا ممکن است نخستین علامت یک اختلال جدی مغزی باشد.
ادم مغزی به عنوان یک اختلال بالقوه تهدیدکننده حیات
ادم مغزی، یا ورم مغز، به تجمع غیرطبیعی مایع در بافت مغز گفته میشود که باعث افزایش فشار داخل جمجمه میگردد. این وضعیت میتواند ناشی از ضربه، سکته، عفونت یا مسمومیت باشد و در صورت عدم تشخیص و درمان به موقع، تهدیدی جدی برای زندگی ایجاد میکند. به دلیل ماهیت پیشرونده و اثر مستقیم ادم مغزی بر عملکرد عصبی، تشخیص سریع و مدیریت مناسب آن اهمیت حیاتی دارد.
علائم هشداردهنده و ضرورت تشخیص سریع
سردردهای شدید میتوانند با علائم هشداردهندهای همراه باشند که به پزشک کمک میکنند تا ادم مغزی یا سایر اختلالات مغزی جدی را شناسایی کند. این علائم شامل تهوع و استفراغ مقاوم، اختلالات بینایی، ضعف یا بیحسی ناگهانی، تغییرات سطح هوشیاری و تشنج هستند. توجه به این نشانهها و مراجعه سریع به پزشک میتواند از پیشرفت بیماری و عوارض شدید جلوگیری کند.
اهداف مقاله و چارچوب تصمیممحور
این مقاله با رویکردی Decision-based طراحی شده است و هدف آن ارائه مسیر تحلیلی برای تعیین اینکه آیا سردردهای شدید میتوانند نشانهای از ادم مغزی باشند یا خیر. ساختار مقاله شامل بررسی مکانیزمهای بروز سردرد، تعریف و عوامل زمینهساز ادم مغزی، روشهای تشخیصی، تفاوت آن با سایر علل سردرد شدید، مطالعات موردی معتبر و راهکارهای درمانی است. در پایان، نتیجهگیری به خواننده کمک خواهد کرد تا تصمیم آگاهانهتری در مواجهه با سردردهای شدید اتخاذ کند.
مکانیزم بروز سردرد در اختلالات مغزی
علل نورولوژیک سردردهای شدید
سردردهای شدید معمولاً نتیجه تحریک ساختارهای عصبی مغز هستند. بافت مغز خود به درد حساس نیست، اما غشاهای مننژ، رگهای خونی مغزی، اعصاب کرانیال و عضلات پیرامون جمجمه به محرکها بسیار حساساند. تحریک این ساختارها در اثر التهاب، تومور، خونریزی یا فشار افزایشیافته، منجر به بروز سردردهای شدید میشود. بهطور مثال، تومورهای مغزی بهصورت موضعی فشار وارد میکنند و ممکن است سردردی پایدار و پیشرونده ایجاد کنند، که با استفراغ و اختلال بینایی همراه است.
نقش فشار داخل جمجمه و ادم مغزی
یکی از مکانیسمهای کلیدی بروز سردرد شدید، افزایش فشار داخل جمجمه است. ادم مغزی باعث تورم بافت مغز و فشردگی رگها و اعصاب حسی میشود. این فشار میتواند علائم مشخصی ایجاد کند، از جمله سردرد ناگهانی، شدید و پیشرونده که اغلب با تهوع، استفراغ و تغییر سطح هوشیاری همراه است. فشار بیشتر ممکن است به فتق مغز منجر شود که وضعیت تهدیدکننده زندگی است و نیاز فوری به اقدامات پزشکی دارد. در شرایط ادم مغزی ناشی از تروما یا سکته، میزان سردرد و علائم همراه میتواند به پزشک کمک کند تا فوریت بالینی را تعیین کند.
تأثیر التهاب و اختلالات عروقی
التهاب مغزی ناشی از عفونتها، بیماریهای خودایمنی یا واکنشهای ایمنی بدن میتواند باعث افزایش نفوذپذیری رگهای خونی و ورود مایع به بافت مغز شود. این فرآیند، ورم و فشار داخل جمجمه را افزایش میدهد و سردرد شدید ایجاد میکند. علاوه بر آن، اختلالات عروقی مانند سکتههای ایسکمیک یا هموراژیک باعث کاهش جریان خون و آسیب سلولی میشوند که خود محرک تورم مغزی است. در این موارد، سردرد غالباً بهصورت ناگهانی، شدید و مقاوم به داروهای معمولی ظاهر میشود و نیازمند تصویربرداری فوری است.
مکانیزمهای مولکولی و پیامرسانهای شیمیایی
عوامل مولکولی مانند افزایش سطح سیتوکینها، پروستاگلاندینها و نوروترنسمیترهای خاص میتوانند باعث التهاب و ورم بافت مغز شوند. این تغییرات نه تنها منجر به درد میشوند، بلکه حساسیت سیستم عصبی مرکزی را افزایش داده و پاسخ به محرکهای محیطی را شدیدتر میکنند. پژوهشهای جدید نشان میدهند که در برخی بیماران، این فرآیندهای مولکولی باعث تشدید ادم مغزی و پیشرفت سریعتر بیماری میشوند.
ارتباط بین شدت سردرد و پیشرفت ادم مغزی
شدت سردرد میتواند شاخص مهمی برای تعیین مرحله پیشرفت ادم مغزی باشد. سردردهای پیشرونده، مقاوم به درمانهای دارویی معمول و همراه با علائم عصبی مانند اختلال بینایی، ضعف اندامها یا تغییر سطح هوشیاری، هشداری جدی برای پزشکان هستند. شناخت الگوی درد و شدت آن به تیم درمانی کمک میکند تا تصمیم سریعتری برای انجام تصویربرداری (CT یا MRI) و اقدامات درمانی فوری اتخاذ کنند.
نمونههای بالینی و اهمیت تشخیص به موقع
مطالعات موردی نشان دادهاند که حتی بیماران با ادم مغزی ناشی از مسمومیت یا عفونت، اگر سردرد شدید و علائم همراه نادیده گرفته شود، ممکن است وضعیتشان به سرعت بحرانی شود. بهعنوان مثال، یک مطالعه موردی از BMC Pediatrics در سال ۲۰۱۸ نشان داد که دختری ۱۳ ساله با ادم مغزی شدید ناشی از مسمومیت با استامینوفن، تنها با تشخیص و مدیریت سریع توانست بهبود کامل پیدا کند. این نمونهها اهمیت تشخیص به موقع سردردهای غیرمعمول را تأکید میکنند.
چشمانداز تشخیصی و تصمیمگیری پزشکی
در عمل بالینی، تحلیل مکانیزمهای سردرد به پزشکان اجازه میدهد تا تصمیمات دقیقتری در مورد نیاز به تصویربرداری و اقدامات اورژانسی اتخاذ کنند. سردردهای شدید که با تغییرات ناگهانی هوشیاری، تهوع مقاوم و اختلالات بینایی همراهاند، نباید بهعنوان یک مشکل ساده تلقی شوند، بلکه باید بهعنوان شاخص اولیه بررسی ادم مغزی و افزایش فشار داخل جمجمه در نظر گرفته شوند.
ادم مغزی چیست و چگونه در بدن شکل میگیرد؟
تعریف ادم مغزی
ادم مغزی یا Brain Edema به تجمع غیرطبیعی مایع در بافت مغز گفته میشود که منجر به افزایش فشار داخل جمجمه و اختلال در عملکرد عصبی میگردد. این وضعیت میتواند در اثر طیف وسیعی از عوامل ایجاد شود، از آسیبهای مستقیم به مغز گرفته تا اختلالات متابولیک و عفونی. ادم مغزی اگر بهموقع تشخیص داده نشود، ممکن است منجر به آسیبهای برگشتناپذیر نورولوژیک یا حتی مرگ بیمار شود.
انواع ادم مغزی و مکانیزمهای شکلگیری
ادم مغزی به طور کلی به چهار نوع تقسیم میشود:
- ادم واسوژنیک (Vasogenic Edema)
این نوع شایعترین فرم ادم مغزی است و ناشی از افزایش نفوذپذیری سد خونی-مغزی است. وقتی سد خونی-مغزی دچار آسیب یا اختلال میشود، پروتئینها و مایعات از رگها وارد فضای بین سلولی مغز میشوند. تومورهای مغزی، عفونتها و التهابهای شدید از علل اصلی این نوع ادم هستند. - ادم سیتوتوکسیک (Cytotoxic Edema)
در این حالت، آسیب به سلولهای مغزی باعث ورود مایع به داخل سلولها میشود و حجم سلولی افزایش مییابد. سکتههای ایسکمیک نمونه بارز ادم سیتوتوکسیک هستند که با اختلال جریان خون و کمبود اکسیژن، سلولها ورم کرده و فشار داخل جمجمه را افزایش میدهند. - ادم آکومولیشن مایع مغزی-نخاعی (Interstitial Edema)
این نوع ادم معمولاً در بیماران مبتلا به هیدروسفالی دیده میشود و به دلیل تجمع مایع در بطنهای مغز و نفوذ آن به بافت اطراف ایجاد میشود. - ادم متابولیک یا رادیکال آزاد
در برخی شرایط نادر مانند اختلالات متابولیک یا مسمومیتهای دارویی، افزایش رادیکالهای آزاد و اختلال در عملکرد سلولی میتواند منجر به ادم مغزی شود.
فرایند فیزیولوژیک شکلگیری ادم مغزی
ادم مغزی زمانی شکل میگیرد که تعادل بین تولید و جذب مایع مغزی-نخاعی و نفوذپذیری رگهای مغزی بر هم بخورد. این اختلال میتواند ناشی از:
- آسیب مستقیم به مغز (ضربه یا جراحی)
- اختلالات عروقی (سکته یا خونریزی)
- عفونتهای مغزی (انسفالیت یا مننژیت)
- اختلالات متابولیک یا مسمومیت دارویی
هنگامی که مایع اضافی در بافت مغز تجمع مییابد، حجم مغز افزایش یافته و فشار داخل جمجمه بالا میرود. این وضعیت باعث فشردگی رگها و کاهش جریان خون مغزی شده و میتواند منجر به اختلال در سطح هوشیاری، تهوع، استفراغ و در موارد شدید، مرگ شود.
علائم بالینی مرتبط با ادم مغزی
ادم مغزی با علائم مشخصی همراه است که پزشکان میتوانند آنها را در ارزیابی بالینی تشخیص دهند. شایعترین این علائم عبارتند از:
- سردرد شدید و پیشرونده
- تهوع و استفراغ مقاوم به درمان
- اختلالات بینایی و دوبینی
- تغییر سطح هوشیاری یا خوابآلودگی
- تشنج و ضعف اندامها
این علائم بسته به شدت و مکان ادم مغزی متفاوت هستند و شناخت دقیق آنها به تشخیص سریع کمک میکند.
ارتباط ادم مغزی با افزایش فشار داخل جمجمه
یکی از پیامدهای مهم ادم مغزی، افزایش فشار داخل جمجمه است. فشار بالای داخل جمجمه باعث کاهش جریان خون مغزی، اختلال عملکرد عصبی و در موارد شدید فتق مغزی میشود. مدیریت سریع و تشخیص به موقع ادم مغزی میتواند از پیشرفت بیماری جلوگیری کرده و نتایج درمانی را بهبود بخشد.
مطالعات موردی و اهمیت بالینی
مطالعات موردی متعدد نشان دادهاند که ادم مغزی میتواند در شرایط غیرمنتظره نیز رخ دهد. برای مثال، دختری ۱۳ ساله با ادم مغزی ناشی از مسمومیت با استامینوفن توانست با مدیریت حمایتی کامل بهبود یابد (BMC Pediatrics, 2018). همچنین در بیماران مبتلا به عفونتهای شدید یا سکته مغزی، تشخیص به موقع ورم مغزی و اقدامات اورژانسی میتواند جان بیمار را نجات دهد.
ارتباط بین افزایش فشار داخل جمجمه و بروز سردردهای شدید
فیزیولوژی فشار داخل جمجمه
فشار داخل جمجمه (Intracranial Pressure – ICP) نشاندهنده نیرویی است که مایع مغزی-نخاعی، خون و بافت مغز بر دیواره جمجمه وارد میکنند. در شرایط طبیعی، ICP بین ۷ تا ۱۵ میلیمتر جیوه (mmHg) است و بدن مکانیسمهای تنظیمی دارد که تعادل بین تولید و جذب مایع مغزی-نخاعی و جریان خون مغزی را حفظ میکنند. هر گونه افزایش غیرطبیعی فشار داخل جمجمه، از جمله ناشی از ادم مغزی، میتواند باعث بروز سردرد شدید و علائم عصبی شود.
ارتباط مستقیم افزایش ICP و سردردهای شدید
ادم مغزی باعث افزایش حجم مغز و فشار بر ساختارهای اطراف میشود. این افزایش فشار باعث تحریک غشاهای درد (meninges) و اعصاب کرانیال میگردد، که نتیجه آن بروز سردردهای شدید، پیشرونده و مقاوم به داروهای معمول است. سردرد ناشی از افزایش ICP اغلب در صبحها شدیدتر است و ممکن است با تهوع و استفراغ همراه باشد، چرا که فشار روی مرکز تهوع در ساقه مغز افزایش یافته است.
الگوهای بالینی سردرد ناشی از ICP
سردردهای مرتبط با افزایش ICP دارای ویژگیهای مشخصی هستند که پزشکان برای تشخیص بالینی به آنها توجه میکنند:
- شروع تدریجی یا ناگهانی بسته به علت ادم
- شدت پیشرونده و مقاوم به درمانهای معمولی
- تغییر الگوهای خواب و اختلال تمرکز
- همراهی با تهوع، استفراغ و اختلال بینایی
- گاهی ایجاد سردرد با سرفه یا عطسه (علت: فشار اضافی موقت در جمجمه)
این الگوها در کنار سایر علائم عصبی به پزشک کمک میکند تا میزان فوریت و نوع اقدامات درمانی مورد نیاز را ارزیابی کند.
عوامل تشدیدکننده فشار داخل جمجمه
چندین عامل میتواند فشار داخل جمجمه را در بیمار مبتلا به ادم مغزی تشدید کند:
- افزایش حجم مایع مغزی-نخاعی: در هیدروسفالی یا انسداد مسیر جریان مایع، فشار سریعاً افزایش مییابد.
- خونریزی یا هماتوم داخل جمجمه: تجمع خون باعث کاهش فضای آزاد و افزایش ICP میشود.
- التهاب و ادم ناشی از سکته یا عفونت: افزایش نفوذپذیری سد خونی-مغزی و ورود مایع به بافت مغز فشار را بالا میبرد.
- تروما یا آسیب فیزیکی به مغز: ورم بافت مغز و خونریزی داخلی، ICP را سریعاً افزایش میدهد.
پیامدهای افزایش طولانیمدت ICP
افزایش طولانیمدت ICP نه تنها باعث سردرد شدید میشود، بلکه میتواند منجر به کاهش جریان خون مغزی، هیپوکسی بافتی و آسیب سلولی شود. در موارد شدید، افزایش فشار میتواند به فتق مغزی و مرگ بیمار منجر شود. بنابراین تشخیص به موقع و مدیریت فشار داخل جمجمه از اهمیت بالایی برخوردار است.
مطالعات بالینی و نمونههای واقعی
مطالعات موردی متعدد نشان میدهند که سردرد شدید اغلب اولین علامت افزایش ICP است. بهعنوان مثال، در یکی از گزارشهای Journal of Pediatric Neurosciences (2014)، کودکی که پس از تروما سر ابتدا حال مساعد داشت، چند روز بعد به طور ناگهانی دچار ورم یک طرفه مغز شد و سردرد شدید و تهوع را تجربه کرد. این نمونه نشان میدهد که حتی در شرایطی که علائم اولیه خفیف هستند، افزایش ICP میتواند به صورت ناگهانی ظاهر شود و نیاز به ارزیابی فوری دارد.
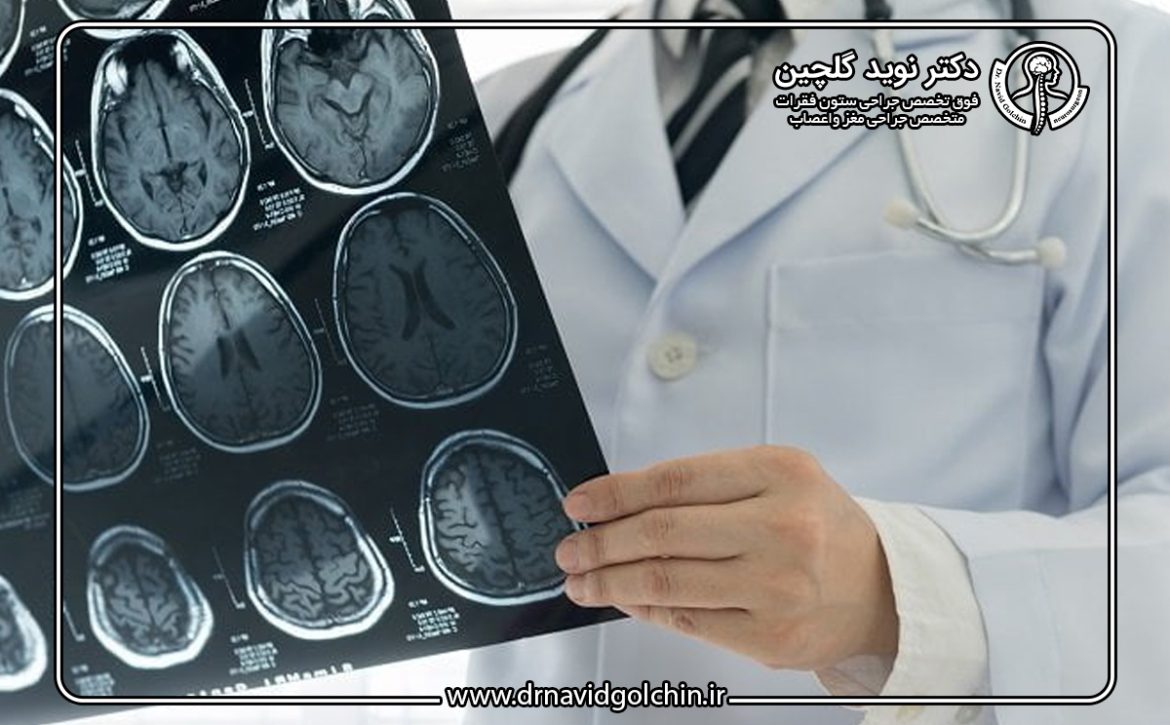
تشخیص و اهمیت تصویربرداری
سیتیاسکن (CT) و امآرآی (MRI) ابزارهای کلیدی برای تشخیص افزایش ICP و ادم مغزی هستند. این روشها امکان شناسایی محل و شدت ادم، بررسی انسداد جریان مایع مغزی-نخاعی و تشخیص هماتوم یا تومور را فراهم میکنند. ترکیب یافتههای تصویربرداری با علائم بالینی مانند سردرد شدید، تهوع و اختلال بینایی به پزشک اجازه میدهد تا تصمیمگیری سریع و دقیق برای مدیریت ادم مغزی اتخاذ کند.
جمعبندی ارتباط سردرد و ICP
سردردهای شدید در بسیاری از موارد، بهویژه زمانی که با تهوع، اختلال بینایی یا تغییر سطح هوشیاری همراه هستند، میتوانند نشانهای از افزایش فشار داخل جمجمه ناشی از ادم مغزی باشند. شناخت این ارتباط و توجه به الگوهای بالینی، امکان تشخیص به موقع، درمان فوری و پیشگیری از عوارض خطرناک را فراهم میکند
عوامل زمینهساز ادم مغزی: از ضربه تا عفونت و مسمومیت
ادم مغزی یک وضعیت پیچیده و چندعاملی است که میتواند ناشی از طیف وسیعی از عوامل باشد. شناخت عوامل زمینهساز این اختلال برای تشخیص سریع، پیشگیری و مدیریت موثر حیاتی است. این عوامل به طور کلی شامل آسیبهای فیزیکی، اختلالات عروقی، عفونتها، مسمومیتها و شرایط سیستمیک میشوند. در ادامه، هر یک از این عوامل به تفصیل بررسی میشوند و نمونههای بالینی معتبر ذکر میگردد.
۱. ضربه و تروما
آسیبهای مستقیم به مغز، از جمله تصادفات رانندگی، سقوط یا ضربههای ورزشی، یکی از شایعترین علل ادم مغزی هستند. تروما باعث آسیب به سلولهای مغزی، خونریزی داخل جمجمه و اختلال در تعادل مایعات میشود که نتیجه آن افزایش فشار داخل جمجمه و سردرد شدید است.
نمونه بالینی: در مطالعه Journal of Pediatric Neurosciences (2014)، کودکی پس از تروما سر، ابتدا حال مساعد داشت اما چند روز بعد به طور ناگهانی دچار ورم یک طرفه مغز شد. این مورد نشان میدهد که ادم مغزی ناشی از تروما میتواند تاخیری ظاهر شود و نیازمند پایش دقیق بیمار است.
۲. اختلالات عروقی
سکتههای مغزی، هموراژیک یا ایسکمیک، یکی دیگر از عوامل مهم زمینهساز ادم مغزی هستند. در سکته ایسکمیک، کاهش جریان خون و کمبود اکسیژن باعث مرگ سلولی و ورم سلولی (ادم سیتوتوکسیک) میشود. در سکته هموراژیک، خونریزی داخل مغز حجم داخل جمجمه را افزایش داده و ادم واسوژنیک ایجاد میکند.
نمونه بالینی: مطالعه Surgical Neurology International (2023) نشان داد که حتی پس از باز کردن رگ با موفقیت (successful thrombectomy) در سکته مغزی، بیمار دچار ادم مغزی بدخیم شد. این هشداردهنده است که مدیریت سکته موفق لزوماً از ورم مغز جلوگیری نمیکند و پایش بیمار پس از درمان ضروری است.
۳. عفونتها و التهاب مغزی
عفونتهای مغزی، مانند انسفالیت، مننژیت و مالاریا مغزی، میتوانند با ایجاد التهاب و افزایش نفوذپذیری رگهای خونی به ادم مغزی منجر شوند. التهاب باعث ورود مایع و پروتئینها به بافت مغز میشود و فشار داخل جمجمه را افزایش میدهد.
نمونه بالینی: در یک گزارش موردی مربوط به مالاریا مغزی، بیمار با ترکیبی از درمانهای دارویی، هیپرونتیلاسیون و خنک کردن کنترلشده مغز توانست از ادم شدید جان سالم به در ببرد. این مثال نشان میدهد که درمان ترکیبی و مراقبت دقیق میتواند حتی در شرایط بحرانی، نتایج موفقیتآمیز داشته باشد.
۴. مسمومیتها و اختلالات متابولیک
برخی مسمومیتها، مانند مسمومیت با استامینوفن، میتوانند به نارسایی کبد و تجمع سموم در بدن منجر شوند و در نهایت باعث ادم مغزی گردند. این نوع ادم اغلب سیتوتوکسیک یا مختلط است و میتواند با سردرد شدید، تهوع، استفراغ و اختلال هوشیاری همراه باشد.
نمونه بالینی: BMC Pediatrics (2018) گزارش داد که دختری ۱۳ ساله با ادم مغزی شدید ناشی از مسمومیت با استامینوفن و نارسایی حاد کبدی، با مراقبت حمایتی کامل به بهبودی کامل رسید. این مطالعه اهمیت تشخیص سریع و مراقبت دقیق را تأکید میکند.
۵. تومورها و ضایعات فضای اشغالکننده
تومورها، کیستها یا ضایعات دیگر مغزی با اشغال فضای محدود داخل جمجمه میتوانند باعث ادم واسوژنیک و افزایش ICP شوند. این اختلال معمولاً با سردرد پیشرونده، تهوع، اختلال بینایی و گاهی تشنج همراه است. تشخیص زودهنگام و ارزیابی با CT یا MRI برای مدیریت مناسب حیاتی است.
۶. شرایط سیستمیک و بیماریهای زمینهای
برخی بیماریهای سیستمیک نیز میتوانند زمینهساز ادم مغزی شوند، از جمله:
- نارسایی کبد یا کلیه: تجمع مایعات و سموم میتواند به تورم مغز منجر شود.
- اختلالات ایمنی: فعالسازی ایمنی یا بازسازی سیستم ایمنی میتواند باعث التهاب و ادم مغزی شود.
- هیپوکسی یا کمبود اکسیژن: در بیماران مبتلا به بیماریهای تنفسی یا قلبی، کمبود اکسیژن سلولی باعث ورم سلولی و ادم مغزی میشود.
نمونه بالینی: مطالعه Journal of Medical Case Reports (2010) نشان داد که یک بیمار مبتلا به HIV و فعالسازی سیستم ایمنی دچار ادم مغزی شدید همراه با لوکوآنسفالاپاتی شد. این مثال اهمیت بررسی علل زمینهای غیرعادی را نشان میدهد.
ملاحظات پزشکی
- ادم مغزی یک اختلال چندعاملی است و تنها ناشی از ضربه یا سکته نیست.
- شناخت علل زمینهساز، از جمله عفونت، مسمومیت، اختلالات سیستمیک و تومورها، برای تشخیص سریع حیاتی است.
- علائم بالینی، به ویژه سردرد شدید همراه با تهوع، استفراغ و اختلال هوشیاری، میتواند شاخص اولیه برای بررسی ادم مغزی باشد.
- مطالعات موردی نشان میدهند که تشخیص سریع و مراقبت دقیق میتواند حتی در موارد شدید، نتیجه موفقیتآمیز داشته باشد.
بررسی بالینی: چه سردردهایی ممکن است نشانهٔ ادم مغزی باشند؟
سردرد یکی از شایعترین علائم بالینی است، اما تشخیص اینکه چه نوع سردردی ممکن است ناشی از ادم مغزی باشد، نیازمند بررسی دقیق ویژگیها و الگوی آن است. ادم مغزی باعث افزایش فشار داخل جمجمه میشود و سردرد ناشی از آن معمولاً با علائم عصبی همراه است و برخلاف سردردهای معمولی، به درمانهای دارویی رایج پاسخ نمیدهد.
ویژگیهای سردرد ناشی از ادم مغزی
سردردهای ناشی از ادم مغزی دارای چند ویژگی بالینی شاخص هستند که پزشکان و متخصصان نورولوژی برای تشخیص سریع به آنها توجه میکنند:
شدت و پیشرونده بودن
- سردرد معمولی ممکن است خفیف تا متوسط باشد و در طول روز کاهش یابد، اما سردرد ناشی از ادم مغزی معمولاً شدید، مداوم و پیشرونده است.
- بیماران اغلب توصیف میکنند که سردردشان «بدترین سردرد زندگی» است و با گذر زمان بدتر میشود.
مقاومت به داروهای معمولی
- سردردهای ناشی از ادم مغزی معمولاً به مسکنهای ساده مانند استامینوفن یا ایبوپروفن پاسخ نمیدهند.
- این مقاومت میتواند شاخصی برای هشدار به پزشک باشد که سردرد نیازمند ارزیابی فوری است.
همراهی با تهوع و استفراغ
- فشار افزایشیافته داخل جمجمه باعث تحریک مرکز تهوع در ساقه مغز میشود.
- تهوع مقاوم و استفراغهای مکرر همراه با سردرد شدید میتواند یکی از شاخصهای بالینی مهم ادم مغزی باشد.
تغییرات دیداری و عصبی
- دوبینی، تاری دید، اختلال در میدان بینایی و حتی کاهش سطح هوشیاری از علائم همراه سردرد ناشی از ادم مغزی هستند.
- این علائم معمولاً به دلیل فشار روی اعصاب کرانیال و ساختارهای بینایی مغز ایجاد میشوند.
الگوی زمانی خاص
- سردردهای ناشی از ادم مغزی غالباً در صبحها شدیدتر هستند و با فعالیت بدنی، سرفه یا عطسه تشدید میشوند.
- علت این الگوی زمانی، افزایش فشار داخل جمجمه در وضعیت خوابیده و تغییرات فشار خون در طول شب است.
تشخیص بالینی و اهمیت ارزیابی فوری
تشخیص بالینی سردرد ناشی از ادم مغزی شامل ترکیبی از تاریخچه پزشکی، معاینه بالینی و مشاهده علائم همراه است:
- تاریخچه پزشکی: بررسی عواملی مانند ضربه اخیر، سکته، عفونت یا مسمومیت که میتوانند باعث ادم مغزی شوند.
- معاینه عصبی: بررسی سطح هوشیاری، وضعیت حرکت اندامها، رفلکسها، و عملکرد اعصاب کرانیال.
- ارزیابی فشار داخل جمجمه: علائم مانند پاپیلدم، تهوع مقاوم و تغییرات بینایی میتوانند نشانه غیرمستقیم افزایش ICP باشند.
مطالعات نشان دادهاند که ترکیب این بررسیها با تصویربرداری سریع، احتمال تشخیص دقیق ادم مغزی را به شدت افزایش میدهد.
نمونههای بالینی واقعی
- سردرد پس از ضربه: کودکانی که بعد از تروما سردرد شدید و تهوع دارند ممکن است دچار ورم مغزی تاخیری شوند، همانطور که در Journal of Pediatric Neurosciences (2014) گزارش شد.
- سردرد ناشی از عفونت: بیماران مبتلا به مالاریا مغزی یا انسفالیت، سردرد شدید همراه با اختلال هوشیاری و تهوع را تجربه میکنند. مدیریت فوری آنها با درمان ترکیبی میتواند نجاتبخش باشد.
- سردرد ناشی از مسمومیت: دختری ۱۳ ساله با مسمومیت استامینوفن دچار سردرد شدید، تهوع و تغییر سطح هوشیاری شد و با مراقبت حمایتی کامل بهبود یافت (BMC Pediatrics, 2018).
این نمونهها اهمیت ارزیابی بالینی دقیق و تشخیص سریع را تأکید میکنند، زیرا سردرد تنها میتواند اولین علامت ادم مغزی باشد.
تمایز سردرد ناشی از ادم مغزی با سایر انواع سردرد
برای تصمیمگیری دقیق، لازم است سردرد ناشی از ادم مغزی از سایر انواع سردردها تمیز داده شود:
- میگرن: معمولاً با نور و صدا حساسیت، تهوع و درد ضرباندار مشخص میشود، اما با داروهای معمولی میتواند کنترل شود.
- سردرد ناشی از فشار خون بالا: غالباً همراه با تاری دید، اما معمولاً پیشرونده نیست و الگوی مقاوم به دارو ندارد.
- سردرد ناشی از تومور: شبها یا صبحها بدتر است و همراه با تهوع، استفراغ و اختلال عصبی است؛ بسیار شبیه ادم مغزی، اما معمولاً تدریجی ظاهر میشود.
تشخیص دقیق بر اساس تاریخچه، معاینه و تصویربرداری صورت میگیرد و باعث میشود اقدامات درمانی اورژانسی به موقع انجام شود.
نکات کلیدی بالینی
- سردردهای شدید که با تهوع، استفراغ، اختلال بینایی و تغییر سطح هوشیاری همراه هستند، ممکن است نشانه ادم مغزی باشند.
- ویژگیهای بالینی و الگوی زمانی سردرد، مقاومت به دارو و علائم عصبی همراه، ابزارهای مهم برای تشخیص بالینی هستند.
- ارزیابی فوری و تصویربرداری دقیق برای تصمیمگیری درمانی، پیشگیری از عوارض شدید و نجات جان بیمار حیاتی است.
روشهای تشخیصی: نقش سیتیاسکن، امآرآی و معاینه عصبی
تشخیص به موقع و دقیق ادم مغزی یکی از چالشهای مهم در نورولوژی و مراقبتهای اورژانسی است. سردردهای شدید، تهوع، استفراغ و اختلالات عصبی ممکن است اولین علائم باشند، اما برای تصمیمگیری درمانی، شواهد تصویربرداری و معاینه بالینی حیاتی هستند. در این بخش، به بررسی ابزارهای اصلی تشخیصی، مزایا و محدودیتهای آنها و کاربرد بالینی هر یک پرداخته میشود.
۱. معاینه عصبی (Neurological Examination)
الف) ارزیابی سطح هوشیاری
یکی از اولین و سادهترین مراحل بررسی بالینی، تعیین سطح هوشیاری بیمار است. این ارزیابی با استفاده از معیارهایی مانند Glasgow Coma Scale (GCS) انجام میشود:
- نمره کمتر از ۸ نشاندهنده اختلال شدید سطح هوشیاری است و نیازمند مراقبت فوری و بررسی افزایش ICP میباشد.
- کاهش تدریجی سطح هوشیاری میتواند نشانه افزایش فشار داخل جمجمه باشد، حتی قبل از ظهور سایر علائم عصبی.
ب) بررسی اعصاب کرانیال
ادم مغزی میتواند فشار روی اعصاب کرانیال ایجاد کند و باعث اختلال در بینایی، حرکت چشم و هماهنگی حرکتی شود. معاینه دقیق شامل بررسی:
- واکنش مردمکها به نور
- حرکت چشمی و دوبینی
- چهره و حرکات اندامهای فوقانی و تحتانی
ج) بررسی رفلکسها و قدرت عضلانی
افزایش فشار داخل جمجمه میتواند مسیرهای عصبی حرکتی را تحت فشار قرار دهد. بررسی رفلکسها و قدرت عضلانی، به تشخیص محل و شدت آسیب مغزی کمک میکند.
د) معاینه پاپیلدم (Papilledema)
پاپیلدم، تورم عصب بینایی به دلیل افزایش ICP، یکی از شاخصهای غیرمستقیم اما حساس برای تشخیص ادم مغزی است. مشاهده پاپیلدم در معاینه چشمی، معمولاً نیازمند پیگیری سریع تصویربرداری است.
۲. سیتیاسکن (CT Scan)
الف) مزایا و کاربردها
سیتیاسکن سریع، در دسترس و ابزار اولیه تشخیص ادم مغزی و افزایش ICP است. کاربردهای اصلی شامل:
- شناسایی خونریزی داخل مغز و هماتوم
- ارزیابی حجم ادم و توزیع آن
- تشخیص تومور یا ضایعات فضاگیر
ب) ویژگیهای تصویری ادم مغزی در CT
- نواحی هیپوچوانس (کمچگال) در بافت مغز که نشاندهنده تجمع مایع هستند
- تغییر شکل بطنها یا فشردگی شکافهای بین مغزی
- تورم بافت مغز و از بین رفتن تمایز بین ماده سفید و خاکستری
ج) محدودیتها
- حساسیت کمتر در شناسایی ادم خفیف یا مناطق کوچک
- اشعه یونیزان، که در بیماران حساس یا کودکان محدودیت ایجاد میکند
۳. امآرآی (MRI)
الف) مزایا و کاربردها
MRI ابزار پیشرفتهتری برای تشخیص ادم مغزی و آسیب بافتی است. مزایای آن شامل:
- دقت بالاتر در تشخیص انواع ادم مغزی (واسوژنیک، سیتوتوکسیک)
- شناسایی ضایعات کوچک، التهاب و نواحی ایسکمیک
- عدم استفاده از اشعه یونیزان
ب) الگوهای تصویری در MRI
- T1 و T2 Weighted Images: شناسایی محل و شدت ادم، تغییرات ماده سفید و خاکستری
- FLAIR Sequence: نمایش بهتر ادم و جلوگیری از اختلال ناشی از مایع مغزی-نخاعی
- Diffusion Weighted Imaging (DWI): تشخیص سریع سکته ایسکمیک و ادم سیتوتوکسیک
ج) محدودیتها
- زمان طولانی تصویربرداری، که ممکن است برای بیماران با وضعیت بحرانی مناسب نباشد
- هزینه بالاتر نسبت به CT
- محدودیت در بیماران دارای ایمپلنت یا تجهیزات فلزی
۴. سایر روشهای تشخیصی تکمیلی
آماره فشار داخل جمجمه (ICP Monitoring)
- در بیماران بحرانی، میتوان فشار داخل جمجمه را به طور مستقیم با سنسورهای کاشتنی یا روشهای غیرتهاجمی اندازهگیری کرد.
- دادههای ICP کمک میکند تا شدت ادم و پاسخ به درمان کنترل شود.
آزمایشهای خون و بیوشیمیایی
- بررسی الکترولیتها، عملکرد کبد و کلیه، و شاخصهای التهابی میتواند عوامل زمینهساز ادم مغزی را شناسایی کند.
- این اطلاعات مکمل تصویربرداری و معاینه عصبی هستند و تصمیمگیری دقیق درمانی را تسهیل میکنند.
۵. نمونههای بالینی و کاربرد ترکیبی روشها
- در یک مطالعه مربوط به مالاریا مغزی، ترکیب معاینه عصبی دقیق و MRI به تشخیص سریع ادم شدید کمک کرد و با درمان ترکیبی بیمار زنده ماند.
- در مورد سکته مغزی پس از thrombectomy موفق، CT اولیه ممکن است ادم خفیف را نشان ندهد، اما MRI و پایش بالینی فشار داخل جمجمه، تشخیص به موقع ورم بدخیم مغزی را ممکن ساخت.
نکات کلیدی بالینی
- تشخیص دقیق ادم مغزی نیازمند ترکیبی از معاینه عصبی کامل، تصویربرداری CT و MRI و پایش فشار داخل جمجمه است.
- معاینه عصبی سریع و دقیق، شامل بررسی سطح هوشیاری، اعصاب کرانیال، رفلکسها و پاپیلدم، میتواند نشانههای اولیه افزایش ICP را نشان دهد.
- CT Scan برای تشخیص سریع خونریزی و ادم گسترده مناسب است، در حالی که MRI جزئیات دقیقتر انواع ادم را نشان میدهد و ابزار مهمی در تصمیمگیری درمانی است.
- استفاده همزمان از چند روش تشخیصی و بررسی عوامل زمینهای، امکان تصمیمگیری دقیق و مدیریت فوری بیمار را فراهم میکند.
تفاوت ادم مغزی با سایر علل سردردهای شدید (میگرن، تومور، فشار خون بالا)
سردرد یکی از رایجترین شکایات بیماران در بخشهای اورژانس و کلینیکهای تخصصی است، اما تشخیص دقیق علت آن اهمیت حیاتی دارد. سردرد ناشی از ادم مغزی نیازمند تشخیص فوری و اقدامات درمانی اورژانسی است، در حالی که بسیاری از سردردهای دیگر مانند میگرن یا سردرد ناشی از فشار خون بالا نیازمند مدیریت طولانیمدت و متفاوت هستند. شناخت ویژگیها و تمایز بالینی این سردردها به پزشکان کمک میکند تا مسیر درمانی صحیح را انتخاب کنند.
۱. تفاوت بالینی سردرد ناشی از ادم مغزی و میگرن
ویژگیهای سردرد میگرنی
- درد ضرباندار و نیمکرهای: غالباً یک طرف سر را درگیر میکند و با فعالیت بدنی افزایش مییابد.
- حساسیت به نور و صدا( Photophobia و Phonophobia): بیماران اغلب ترجیح میدهند در محیط تاریک و آرام باشند.
- مدت زمان: معمولاً ۴ تا ۷۲ ساعت طول میکشد.
- پاسخ به دارو: مسکنهای معمولی، تریپتانها یا داروهای پیشگیریکننده میتوانند درد را کاهش دهند.
ویژگیهای سردرد ناشی از ادم مغزی
- درد شدید و پیشرونده: معمولاً مقاوم به داروهای مسکن رایج است.
- همراه با علائم عصبی: تهوع مقاوم، استفراغ، اختلال دید، تغییر سطح هوشیاری.
- تشدید در صبح یا با تغییر فشار داخل جمجمه: برخلاف میگرن، این سردرد ممکن است با خوابیدن یا فعالیتهای بدنی بدتر شود.
۲. تفاوت سردرد ناشی از ادم مغزی و تومور مغزی
ویژگیهای سردرد ناشی از تومور
- شروع تدریجی: رشد آهسته تومور باعث بروز سردرد پیشرونده طی هفتهها یا ماهها میشود.
- الگوی شبانه یا صبحگاهی: اغلب صبحها شدیدتر است و با تهوع همراه است.
- اختلالات عصبی موضعی: ممکن است با ضعف اندامها، تشنج یا اختلالات بینایی همراه باشد.
- تغییرات تصویربرداری: MRI یا CT اغلب ضایعه مشخص و فضای اشغالکننده نشان میدهد.
ویژگیهای سردرد ناشی از ادم مغزی
- شروع حاد یا ناگهانی: اغلب با علت زمینهای مانند ضربه، سکته یا مسمومیت مرتبط است.
- پیشرونده سریع: ظرف ساعات تا چند روز علائم بدتر میشوند.
- علائم سیستمیک و عصبی شدید: تهوع مقاوم، تغییر سطح هوشیاری، دوبینی، ضعف دوطرفه اندامها.
- تغییرات تصویربرداری: تورم گسترده بافت مغز، ممکن است بدون ضایعه مشخص تومورال باشد.
۳. تفاوت سردرد ناشی از ادم مغزی و فشار خون بالا (Hypertensive Headache)
ویژگیهای سردرد ناشی از فشار خون بالا
- درد خفیف تا متوسط، غالباً سرتاسری: بیشتر در پشت سر یا پیشانی احساس میشود.
- تشدید با فعالیت بدنی یا استرس: به تغییرات فشار خون حساس است.
- علائم همراه محدود: معمولاً بدون تهوع مقاوم، استفراغ یا اختلال هوشیاری شدید.
- پاسخ به درمان فشار خون: کنترل فشار خون غالباً سردرد را بهبود میبخشد.
ویژگیهای سردرد ناشی از ادم مغزی
- شدت شدید و پیشرونده: مقاومت به داروهای رایج.
- همراه با تهوع، استفراغ و اختلالات عصبی: شاخص بالینی مهم.
- نشانههای تصویربرداری: تورم بافت مغز و افزایش ICP، نه صرفاً فشار خون بالا.
۴. الگوریتم تشخیص تمایزی سردرد شدید
شروع و شدت:
- ناگهانی و شدید → ادم مغزی یا سکته
- تدریجی و پیشرونده → تومور
- متناوب و ضرباندار → میگرن
علائم همراه:
- تهوع مقاوم، استفراغ، اختلال هوشیاری → ادم مغزی
- تهوع خفیف، حساسیت به نور و صدا → میگرن
- اختلالات عصبی موضعی، تشنج → تومور
پاسخ به دارو:
- مقاوم → ادم مغزی
- بهبود با مسکن یا تریپتان → میگرن
- نیازمند درمان طولانی و مدیریت علت → تومور
تصویربرداری:
- تورم گسترده مغز بدون ضایعه مشخص → ادم مغزی
- ضایعه فضاگیر مشخص → تومور
- بدون تغییر واضح → میگرن یا فشار خون بالا
۵. اهمیت تشخیص دقیق و فوری
تشخیص نادرست یا تأخیر در شناسایی ادم مغزی میتواند منجر به:
- آسیب دائمی مغز
- افزایش فشار داخل جمجمه و کاهش جریان خون مغزی
- مرگ در موارد شدید
تمایز بالینی و استفاده از تصویربرداری مناسب، به همراه ارزیابی عوامل زمینهای، کلید موفقیت در مدیریت این بیماران است.
۶. نمونههای بالینی مرتبط
- سردرد پس از ضربه: کودک با سردرد ناگهانی و تهوع مقاوم، تشخیص ادم مغزی تاخیری داده شد و درمان سریع مانع آسیب دائمی شد.
- سردرد تدریجی: بیمار با تومور مغزی، سردرد پیشرونده و اختلال عصبی موضعی داشت؛ MRI ضایعه مشخص را نشان داد.
- سردرد مقاوم به مسکن: فردی با سردرد شدید و افزایش ICP ناشی از مسمومیت دارویی؛ CT و MRI تورم گسترده مغز را نشان داد و مراقبت حمایتی موفقیتآمیز بود.
جمعبندی
- سردرد ناشی از ادم مغزی حاد، پیشرونده، مقاوم به دارو و همراه با علائم عصبی است.
- میگرن معمولاً ضرباندار، جانبی و با حساسیت به نور و صدا است.
- سردرد ناشی از تومور مغزی تدریجی و همراه با ضایعه موضعی میباشد.
- سردرد ناشی از فشار خون بالا خفیف تا متوسط و قابل کنترل است.
- تشخیص دقیق و استفاده از تصویربرداری و معاینه عصبی برای تصمیمگیری درمانی اورژانسی حیاتی است.
راهکارهای درمانی و مدیریت پزشکی ادم مغزی
ادم مغزی یک وضعیت اورژانسی بالقوه تهدیدکننده حیات است که نیازمند تصمیمگیری سریع و مدیریت چندجانبه پزشکی میباشد. هدف درمان کاهش فشار داخل جمجمه، پیشگیری از آسیب مغزی دائمی و بهبود علائم بیمار است. استراتژی درمانی ترکیبی شامل مراقبت حمایتی، دارودرمانی، مداخلات جراحی و پایش مداوم بالینی است.
۱. مدیریت اولیه اورژانسی (Stabilization)
الف) حفظ راه هوایی و تهویه مناسب
- بیماران با کاهش سطح هوشیاری یا تهوع شدید ممکن است نیازمند تهویه مکانیکی باشند.
- هدف حفظ اکسیژن کافی به مغز و پیشگیری از هیپوکسیا است، زیرا کاهش اکسیژن خون میتواند آسیب مغزی را تشدید کند.
ب) پایش وضعیت همودینامیک
- کنترل فشار خون، ضربان قلب و حجم مایعات حیاتی است.
- افزایش یا کاهش شدید فشار خون میتواند جریان خون مغزی را مختل کند و باعث تشدید ادم شود.
ج) پایش سطح هوشیاری و علائم عصبی
- استفاده از Glasgow Coma Scale (GCS) و معاینه عصبی مداوم برای تشخیص تغییرات سریع وضعیت بیمار ضروری است.
- علائم هشدار دهنده مانند افزایش تهوع، استفراغ یا اختلال دید، نیازمند اقدامات فوری هستند.
۲. درمان دارویی (Medical Therapy)
الف) داروهای ادم مغزی ناشی از فشار داخل جمجمه
- اوسموتیکها (Osmotic Agents)
- مانند منیتول و گلیسیرین: باعث کاهش فشار داخل جمجمه و خارج کردن مایع اضافی از مغز میشوند.
- اثر سریع دارد و معمولاً در بیماران اورژانسی استفاده میشود.
- کورتیکواستروئیدها (Corticosteroids)
- مانند دگزامتازون: به ویژه در ادم ناشی از تومور یا التهاب مفید هستند.
- کاهش تورم بافتی و فشار داخل جمجمه از طریق مهار التهاب و افزایش جذب مایع انجام میشود.
- مدیریت فشار خون و الکترولیتها
- کنترل سدیم و پتاسیم خون برای جلوگیری از تشدید ادم اهمیت دارد.
- فشار خون باید در محدوده مناسب نگه داشته شود تا جریان خون مغزی حفظ شود.
ب) کنترل علائم همراه
- ضد تهوعها: مانند اونداسترون برای کاهش تهوع و استفراغ.
- مسکنهای قوی: در صورت نیاز، برای کاهش درد شدید بیمار.
- آنتیبیوتیک یا درمان ضد ویروس: در صورت ادم ناشی از عفونت مغزی.
۳. درمان جراحی (Surgical Intervention)
الف) دکمپرسیون کرانیال (Decompressive Craniectomy)
- در موارد ادم بدخیم یا مقاوم به درمان دارویی، برداشتن قسمتی از جمجمه برای کاهش فشار ضروری است.
- این روش به کاهش سریع فشار داخل جمجمه و جلوگیری از آسیب دائمی مغز کمک میکند.
ب) تخلیه مایع مغزی-نخاعی (CSF Drainage)
- در مواردی که هیدروسفالی یا تجمع مایع وجود دارد، لولهگذاری و تخلیه مایع میتواند فشار داخل جمجمه را کاهش دهد.
ج) مدیریت ضایعات زمینهای
- تومورها، هماتومها یا آبسهها ممکن است نیاز به جراحی فوری داشته باشند.
- درمان مستقیم علت زمینهای اغلب باعث بهبود ادم و کاهش علائم میشود.
۴. مراقبت حمایتی (Supportive Care)
الف) موقعیت سر و بدن
- سر بیمار باید کمی بالاتر از سطح بدن قرار گیرد تا تخلیه وریدی مغز تسهیل شود.
- جلوگیری از خم شدن گردن و فشار اضافی به جمجمه اهمیت دارد.
ب) کنترل دمای بدن
- هایپوترمی کنترلشده (Therapeutic Hypothermia) در برخی موارد، مانند ادم ناشی از مالاریا یا آسیب مغزی شدید، به کاهش تورم مغزی کمک میکند.
ج) تغذیه و مایعات
- مایعات باید با دقت کنترل شوند تا از افزایش ادم ناشی از هیپرولمی جلوگیری شود.
- تغذیه کافی برای حمایت از بهبود متابولیسم مغز ضروری است.
۵. پایش و ارزیابی مداوم
الف) تصویربرداری مکرر
- CT یا MRI پیدرپی برای بررسی پاسخ به درمان و تشخیص پیشرفت یا کاهش ادم لازم است.
ب) پایش فشار داخل جمجمه
- ICP Monitoring در ICU به پزشکان اجازه میدهد تا درمان دارویی یا جراحی را به صورت دقیق تنظیم کنند.
ج) پیگیری علائم عصبی
- بررسی مستمر تغییرات سطح هوشیاری، حرکت اندامها و علائم بینایی، شاخص مهم برای ارزیابی اثربخشی درمان است.
۶. نمونههای بالینی موفق
- مسمومیت استامینوفن: دختری ۱۳ ساله با ادم مغزی شدید به علت مسمومیت، با درمان حمایتی، دارویی و پایش دقیق، بهبودی کامل یافت (BMC Pediatrics, 2018).
- مالاریا مغزی: بیمار با ادم شدید، تحت درمان ترکیبی دارویی، هیپرونتیلاسیون و خنک کردن کنترلشده، از مرگ نجات یافت.
- سکته ایسکمیک: حتی پس از باز کردن رگ، ادم بدخیم ممکن است ظاهر شود؛ پایش دقیق و مداخلات جراحی به جلوگیری از عوارض کمک میکند.
۷. نکات کلیدی برای مدیریت موفق
- تشخیص سریع و تصمیمگیری اورژانسی حیاتی است.
- درمان ترکیبی دارویی، جراحی و مراقبت حمایتی بهترین نتایج را به همراه دارد.
- پایش مداوم فشار داخل جمجمه و وضعیت عصبی، پیشگیری از عوارض و بهبود بقا را تضمین میکند.
- همکاری تیمی شامل نورولوژیست، جراح مغز و اعصاب، ICU و پرستاران متخصص ضروری است.
بیشتر بخوانید:ادم مغزی چگونه در چند دقیقه جان بیمار را تهدید می کند؟
نتیجهگیری و اهمیت توجه به سردردهای شدید
سردردهای شدید میتوانند تنها یک ناراحتی گذرا نباشند و در مواردی، نشانهای از اختلالات مغزی تهدیدکننده حیات مانند ادم مغزی باشند. تشخیص به موقع و دقیق این شرایط اهمیت بالایی دارد، زیرا تأخیر در شناسایی یا مدیریت میتواند منجر به افزایش فشار داخل جمجمه، آسیب دائمی مغزی و حتی مرگ شود.
مطالعات بالینی و گزارشهای موردی نشان میدهند که ادم مغزی میتواند از علل متنوعی ناشی شود، از جمله ضربه به سر، سکته مغزی، عفونتهای مغزی، مسمومیت دارویی و اختلالات سیستمیک. علائم هشداردهندهای مانند تهوع مقاوم، استفراغ، تغییر سطح هوشیاری و اختلالات عصبی موضعی باید همواره جدی گرفته شوند و بیمار باید سریعاً تحت بررسی تصویربرداری و معاینه عصبی قرار گیرد.
مدیریت ادم مغزی نیازمند رویکردی ترکیبی است: پایش بالینی مداوم، درمان دارویی با اوسماوتیکها و کورتیکواستروئیدها، مداخلات جراحی در موارد مقاوم، و مراقبت حمایتی دقیق. تجربه بالینی نشان میدهد که تشخیص سریع و اقدامات درمانی مناسب، حتی در موارد شدید، میتواند منجر به بهبودی کامل بیمار شود.
در نهایت، این مقاله بر ضرورت توجه جدی به سردردهای شدید و مسیر تصمیمگیری بالینی تاکید میکند. پزشکان و بیماران باید بدانند که صرفاً درد شدید سر نباید نادیده گرفته شود؛ بلکه بررسی دقیق، استفاده هوشمند از ابزارهای تشخیصی و شروع سریع درمان، کلید پیشگیری از پیامدهای جدی است.
پیام عملی: هرگاه سردردی ناگهانی، شدید و مقاوم به مسکنهای معمول همراه با علائم عصبی مشاهده شد، مراجعه فوری به پزشک و بررسی دقیق میتواند جان بیمار را نجات دهد.
منابع
- Austin EB, Hobbs H, et al. A case report of full recovery from severe cerebral edema secondary to acetaminophen‑induced hepatotoxicity in a 13 year old girl. BMC Pediatrics, 2018.
- Oelschlaeger C, Dziewas R, et al. Severe leukoencephalopathy with fulminant cerebral edema reflecting immune reconstitution inflammatory syndrome during HIV infection: a case report. J Med Case Rep, 2010.
- Paiva WS, Beer-Furlan A, et al. Delayed unilateral traumatic brain swelling in a child: case report and physiopathological review. J Pediatr Neurosci, 2014.
- Monteiro S, Teixeira B, et al. Acute Fulminant Cerebral Edema in a Child With Suspected Meningoencephalitis. Cureus, 2023.
- Case report. Severe Cerebral Malaria Managed with Therapeutic Hypothermia for Brain Edema. PubMed, 2018.
- Prolonged hypothermia as a bridge to recovery for cerebral edema and intracranial hypertension. PubMed.
- Sahu PK, Duffy FJ, et al. Determinants of brain swelling in pediatric and adult cerebral malaria. JCI Insight.
- Imataka G, Kuwashima S, et al. A Comprehensive Review of Pediatric Acute Encephalopathy. J Clin Med, 2022.
- Alawadhi A, Saint‑Martin C, et al. Acute hemorrhagic encephalitis responding to combined decompressive craniectomy, IVIG, and corticosteroid therapies. Front Neurol, 2018.