تشخیص تومور هیپوفیز در MRI چگونه انجام می شود؟
تشخیص تومور هیپوفیز در MRI چگونه انجام می شود؟
مقدمه
اهمیت بالینی تومورهای هیپوفیز در تصمیمگیری پزشکی
تشخیص هیپوفیز یکی از مراحل کلیدی در ارزیابی بیماران با اختلالات هورمونی و تومورهای ناحیه سلار است. تومورهای هیپوفیز، از جمله آدنومهای ترشحی و غیرترشحی، میتوانند تأثیرات بالینی متنوعی داشته باشند که از تغییرات هورمونی تا فشار بر ساختارهای عصبی و بینایی را شامل میشود. MRI به عنوان ابزار استاندارد و غیرتهاجمی، امکان بررسی دقیق آناتومی هیپوفیز، ارزیابی اندازه و مرز تومورها، شناسایی میکروآدنومها و تشخیص ضایعات پیچیده یا ترکیبی را فراهم میکند. دقت در تشخیص هیپوفیز با استفاده از MRI، نه تنها به تعیین نوع و موقعیت تومور کمک میکند، بلکه پایهای برای تصمیمگیری بالینی و انتخاب استراتژی درمانی مناسب، شامل جراحی، درمان دارویی یا پیگیری، محسوب میشود. با توجه به اهمیت تشخیص دقیق و محدودیتهای بالقوه MRI، استفاده از پروتکلهای استاندارد و توالیهای پیشرفته تصویر برداری ضروری است تا خطاهای تشخیصی کاهش یافته و نتایج درمانی بهینه شوند.
چرا تشخیص تومور هیپوفیز یک مسئله Decision-Based است
تشخیص تومور هیپوفیز صرفاً به معنای شناسایی یک ضایعه نیست، بلکه فرآیندی تصمیممحور است که مسیر درمان بیمار را مشخص میکند. انتخاب بین پیگیری محافظهکارانه، درمان دارویی، جراحی ترانساسفنوئیدال یا رادیوتراپی، همگی وابسته به اطلاعاتی هستند که از تصویربرداری MRI به دست میآیند. بنابراین MRI نهتنها یک ابزار تشخیصی، بلکه یک عامل کلیدی در تصمیمسازی بالینی محسوب میشود.
نقش MRI بهعنوان استاندارد طلایی تصویربرداری هیپوفیز
MRI به دلیل کنتراست بالای بافت نرم، توانایی تصویربرداری چندصفحهای و امکان استفاده از توالیهای پیشرفته، بهعنوان استاندارد طلایی در ارزیابی تومورهای هیپوفیز شناخته میشود. برخلاف CT، MRI قادر است تفاوتهای ظریف بین بافت طبیعی هیپوفیز و ضایعات کوچک مانند میکروآدنومها را آشکار کند، موضوعی که در تصمیمگیری درمانی اهمیت حیاتی دارد.
چالشهای تشخیصی اولیه در MRI هیپوفیز
با وجود مزایای متعدد MRI، تشخیص تومور هیپوفیز همواره ساده نیست. شباهتهای تصویری بین آدنومها و سایر ضایعات ناحیه سلار مانند کیست راثکه، مننژیوم یا تومورهای نادر، میتواند منجر به تصمیمگیری نادرست شود. این چالشها ضرورت یک رویکرد سیستماتیک و الگوریتممحور در تفسیر MRI را برجسته میکنند.
جایگاه الگوریتم MUM در ساختار تشخیص
الگوریتم MUM با تأکید بر تحلیل چندمرحلهای دادهها، تطبیق یافتههای تصویربرداری با علائم بالینی و ارزیابی چندبعدی ضایعه، چارچوبی مناسب برای تشخیص تومور هیپوفیز فراهم میکند. در این مقاله، تشخیص MRI تومورهای هیپوفیز نه بهصورت توصیفی، بلکه بهعنوان یک فرآیند تصمیمسازی گامبهگام بررسی خواهد شد.
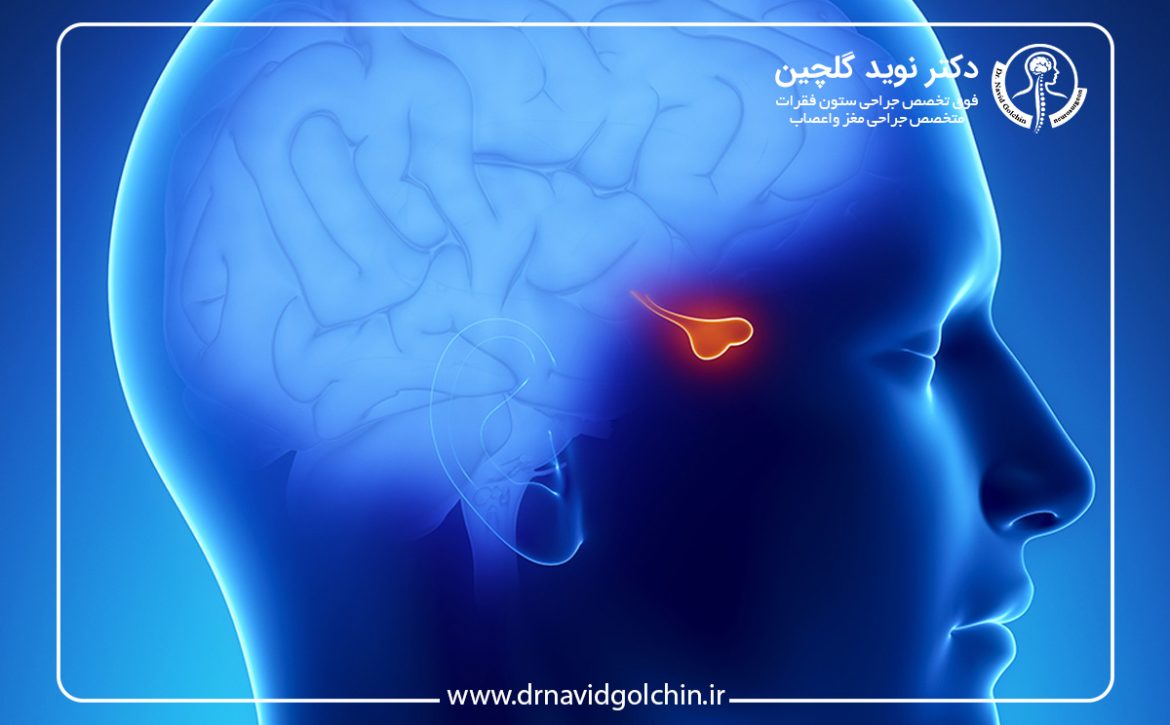
آناتومی طبیعی هیپوفیز در MRI و نکات کلیدی تفسیر
جایگاه آناتومیک هیپوفیز در ناحیه سلار
غده هیپوفیز در حفره استخوانی سلا تورسیکا واقع شده و توسط ساختارهای حیاتی متعددی احاطه میشود که هرگونه تغییر حجمی یا مورفولوژیک آن میتواند پیامدهای بالینی مهمی داشته باشد. درک دقیق موقعیت هیپوفیز نسبت به کیاسم بینایی، سینوسهای کاورنوس و ساقه هیپوفیز، نخستین گام در تفسیر صحیح تصاویر MRI و تصمیمگیری تشخیصی است. هرگونه قضاوت درباره وجود تومور، بدون شناخت آناتومی طبیعی، منجر به افزایش خطای تشخیصی خواهد شد.
تقسیمبندی آناتومیک هیپوفیز و اهمیت آن در MRI
هیپوفیز از دو بخش اصلی آدنوهیپوفیز و نورو هیپوفیز تشکیل شده است که هرکدام ویژگیهای تصویری متفاوتی در MRI دارند. آدنوهیپوفیز معمولاً سیگنال ایزو تا هیپواینتنس نسبت به ماده خاکستری مغز در تصاویر T1 دارد، در حالی که نورو هیپوفیز بهطور طبیعی در T1 بهصورت یک نقطه یا ناحیه هایپراینتنس دیده میشود که به آن bright spot گفته میشود. حفظ یا فقدان این bright spot میتواند در تصمیمگیری تشخیصی نقش کلیدی داشته باشد.
نمای طبیعی هیپوفیز در توالیهای مختلف MRI
در توالی T1 بدون تزریق، هیپوفیز طبیعی ساختاری همگن با حدود مشخص دارد. در توالی T2، سیگنال معمولاً ناهمگنتر به نظر میرسد، اما همچنان مرزهای آن قابل تشخیص است. پس از تزریق ماده حاجب، هیپوفیز طبیعی بهصورت سریع و یکنواخت enhancement پیدا میکند. این الگوی enhancement مبنای تصمیمگیری در تشخیص میکروآدنومها است، زیرا میکروآدنومها معمولاً enhancement تأخیری نسبت به بافت طبیعی دارند.
تغییرات طبیعی اندازه و شکل هیپوفیز
اندازه و شکل هیپوفیز میتواند تحت تأثیر سن، جنس و وضعیت فیزیولوژیک بیمار تغییر کند. در نوجوانان و زنان باردار، هیپوفیز ممکن است بزرگتر و محدبتر دیده شود، حالتی که در صورت عدم توجه میتواند با ماکروآدنوم اشتباه گرفته شود. تصمیمگیری صحیح در این شرایط مستلزم تطبیق یافتههای MRI با اطلاعات بالینی و هورمونی بیمار است، که یکی از اصول الگوریتم MUM محسوب میشود.
ساقه هیپوفیز و نقش آن در تفسیر MRI
ساقه هیپوفیز بهطور طبیعی در خط وسط قرار دارد و هرگونه انحراف آن میتواند نشانه وجود ضایعه فضاگیر باشد. در MRI، ضخامت و موقعیت ساقه باید بهدقت بررسی شود، زیرا انحراف یا ضخیمشدگی ساقه میتواند به افتراق بین آدنوم هیپوفیز و سایر ضایعات التهابی یا نفوذی کمک کند. این ارزیابی نقش مهمی در تصمیمگیری درمانی دارد.
کیاسم بینایی و ارتباط آن با هیپوفیز
فاصله و ارتباط هیپوفیز با کیاسم بینایی از مهمترین معیارهای تصمیمگیری بالینی است. در حالت طبیعی، فاصله مناسبی بین سقف هیپوفیز و کیاسم وجود دارد. نزدیک شدن یا تماس هیپوفیز با کیاسم میتواند حتی در غیاب علائم بینایی، اهمیت تشخیصی داشته باشد و مسیر پیگیری یا مداخله درمانی را تغییر دهد.
نکات کلیدی تفسیری برای کاهش خطای تشخیص
تفسیر آناتومی طبیعی هیپوفیز در MRI باید همواره بهصورت سیستماتیک انجام شود. بررسی تقارن، همگنی سیگنال، الگوی enhancement، موقعیت ساقه و ارتباط با ساختارهای مجاور، مجموعهای از تصمیمهای کوچک اما حیاتی را شکل میدهد. این تصمیمها پایه و اساس تشخیص تومور هیپوفیز در مراحل بعدی مقاله خواهند بود.
انواع تومورهای هیپوفیز و طبقهبندی آنها
انواع اصلی تومورهای هیپوفیز
تومورهای هیپوفیز بر اساس چند معیار طبقهبندی میشوند که شامل اندازه، نوع سلولی، فعالیت هورمونی و ویژگیهای تصویربرداری MRI است. تقسیمبندی دقیق این تومورها برای برنامهریزی درمان و پیشبینی عوارض بالینی اهمیت ویژهای دارد.
۱. آدنومهای هیپوفیز
آدنومها شایعترین تومورهای هیپوفیز هستند و به دو دسته اصلی تقسیم میشوند: میکروآدنومها و ماکروآدنومها.
- میکروآدنومها: تومورهایی با قطر کمتر از ۱۰ میلیمتر هستند و اغلب به صورت تصادفی در MRI شناسایی میشوند. این آدنومها معمولاً بدون تظاهر بالینی شدید هستند، اما در صورت ترشح هورمونی غیرطبیعی، ممکن است علائم اندوکرینی مانند هایپرپرولاکتینمی یا سندرم کوشینگ ایجاد کنند.
- ماکروآدنومها: قطر بیشتر از ۱۰ میلیمتر دارند و میتوانند به ساختارهای اطراف، از جمله ساقه هیپوفیز و اعصاب بینایی فشار وارد کنند. در MRI، ماکروآدنومها به صورت ضایعات هموژن یا هتروژن با enhancement متغیر پس از تزریق کنتراست دیده میشوند.
۲. آدنومهای ترشحی و غیرترشحی
آدنومها بر اساس فعالیت هورمونی به دو گروه تقسیم میشوند:
- آدنوم ترشحی: شامل تومورهایی است که هورمونهای خاصی مانند پرولاکتین، رشد هورمون (GH)، ACTH یا TSH را تولید میکنند. در MRI، این تومورها ممکن است تغییرات مورفولوژیک خاصی نشان دهند، مثل هایپرواسینسیتی نسبی در توالی T1 یا T2، که میتواند به افتراق آنها از آدنوم غیرترشحی کمک کند.
- آدنوم غیرترشحی (Silent Adenoma): این نوع آدنومها هورمون ترشح نمیکنند و معمولاً با تظاهرات فشاری یا تغییرات بینایی به پزشک مراجعه میکنند. شناسایی آنها در MRI بیشتر بر اساس اندازه، مرزها و رفتار تومور انجام میشود.
۳. تومورهای نادر هیپوفیز
علاوه بر آدنومها، انواع دیگری از تومورهای هیپوفیز وجود دارند که در MRI تشخیص آنها نیازمند دقت بالا است:
- Craniopharyngioma: توموری شایع در کودکان و بالغین جوان که معمولاً حاوی بخشهای کیستیک و کلسیم است. MRI این تومورها را به صورت ضایعات ترکیبی نشان میدهد که تفاوت آنها با آدنومهای هیپوفیز اهمیت بالینی دارد.
- Rathke’s Cleft Cyst :کیستهای غدد هیپوفیز که اغلب بدون تظاهر بالینی هستند، اما در MRI به شکل ضایعات مایعدار دیده میشوند. توالی T1 و T2 برای افتراق آنها از میکروآدنومها حیاتی است.
- Pituicytoma و Glioma: تومورهای نادر غیرترشحی که بیشتر در بخش خلفی هیپوفیز یا ساقه دیده میشوند و در MRI به شکل ضایعات هموژن با مرز مشخص یا نسبی ظاهر میشوند.
۴. تومورهای ترکیبی و چندگانه
در موارد نادر، بیماران ممکن است بیش از یک نوع تومور هیپوفیز داشته باشند. این حالت در Unusual Double Pituitary Adenoma مشاهده میشود که شامل دو آدنوم با نماهای رادیولوژیک متفاوت و پروفایل ایمونوهیستوشیمی جداگانه است. تشخیص MRI دقیق برای افتراق این تومورها ضروری است و میتواند مسیر جراحی و درمان دارویی را تعیین کند.
۵. طبقهبندی بر اساس الگوهای MRI
MRIنقش کلیدی در طبقهبندی و شناسایی نوع تومور ایفا میکند. پارامترهای مورفولوژیک مهم شامل:
- اندازه و حجم تومور
- مرزها و فرم تومور (هموژن یا هتروژن)
- الگوهای enhancement پس از تزریق ماده حاجب
- اثر بر ساختارهای اطراف مانند ساقه هیپوفیز، سینوسهای غاری و عصب بینایی
این ویژگیها به پزشکان امکان میدهد تا بین آدنومها، کرانیوفارینگیوما، کیستها و سایر ضایعات هیپوفیز افتراق قائل شوند و تصمیمات درمانی بهینه را اتخاذ کنند.
۶. ارتباط بالینی و پیشبینی عوارض
تومورها بر اساس نوع، اندازه و الگوی MRI میتوانند منجر به اختلالات بینایی، سندرمهای هورمونی، و اختلالات متابولیک شوند. در نتیجه، طبقهبندی دقیق MRI نه تنها برای تشخیص اولیه بلکه برای پیشبینی عوارض و برنامهریزی درمان جراحی یا دارویی اهمیت دارد.
پروتکلهای استاندارد MRI در بررسی هیپوفیز
اهمیت پروتکلهای MRI استاندارد
تصویربرداری MRI هیپوفیز یکی از ابزارهای کلیدی در تشخیص و مدیریت تومورهای هیپوفیز است. اجرای پروتکلهای استاندارد MRI باعث افزایش دقت تشخیصی، افتراق ضایعات و کاهش خطاهای افتراقی میشود. انتخاب درست توالیها و پارامترهای تصویربرداری به پزشک کمک میکند تا اندازه، موقعیت و رفتار تومور را به دقت ارزیابی کند.
۱. توالیهای پایه MRI
برای بررسی هیپوفیز، معمولاً از ترکیب چند توالی MRI استفاده میشود:
- T1-Weighted Imaging:این توالی پایهای برای ارزیابی مورفولوژی هیپوفیز و شناسایی ضایعات است. تومورهای هیپوفیز اغلب هیپواینتنس نسبت به غده نرمال دیده میشوند و در میکروآدنومها بهویژه پس از تزریق کنتراست تفاوت واضحتری ایجاد میشود.
- T2-Weighted Imaging: در این توالی، بافتهای مایع و کیستیک روشن و بافتهای جامد تیرهتر دیده میشوند. این توالی برای شناسایی بخشهای کیستیک آدنومها یا کرانیوفارینگیوما مفید است.
- Fluid-Attenuated Inversion Recovery (FLAIR): استفاده محدود اما گاهی کاربردی برای تمایز ضایعات خلفی هیپوفیز و اثرات اطراف.
۲. توالیهای اختصاصی برای آدنومهای هیپوفیز
- Dynamic Contrast-Enhanced MRI (DCE-MRI): توالیهای داینامیک با تزریق گادولینیوم، حساسیت تشخیصی برای میکروآدنومها را به شدت افزایش میدهد. آدنومها معمولاً دیرتر از بافت نرمال enhancement میشوند و این الگو به تشخیص دقیق کمک میکند.
- High-Resolution Coronal and Sagittal Imaging: برشهای نازک ۲–۳ میلیمتری در محورهای کرونال و ساژیتال برای ارزیابی دقیق اندازه، مرزها و فشار بر ساختارهای اطراف ضروری است.
۳. استفاده از ماده حاجب (Contrast Agent)
- گادولینیوم رایجترین ماده حاجب است و بهصورت وریدی تزریق میشود.
- الگوی enhancement پس از تزریق میتواند به تمایز آدنوم از کرانیوفارینگیوما یا کیستهای Rathke کمک کند.
- در ماکروآدنومهای با گسترش سوپراسِلار، تزریق کنتراست به شناسایی مرزهای تومور و اثر آن بر عصب بینایی کمک میکند.
۴. پروتکل پیشنهادی برای میکروآدنومها
- برشهای کرونال T1 قبل از تزریق کنتراست
- برشهای کرونال T1 بعد از تزریق گادولینیوم با توالی داینامیک
- برشهای ساژیتال برای بررسی اندازه و اثر تومور بر ساقه هیپوفیز
- توالی T2 برای ارزیابی بخشهای کیستیک و افتراق از بافت نرمال
۵. پروتکل پیشنهادی برای ماکروآدنومها و تومورهای پیچیده
- ترکیب کرونال و ساژیتال T1 و T2 با برشهای نازک
- DCE-MRI برای افتراق بخشهای ترشحی و غیرترشحی
- در موارد گسترش سوپراسِلار یا فشار بر عصب بینایی، استفاده از TOF MR angiography برای بررسی عروق اطراف
- ارزیابی پیوستگی با سینوس غاری، ساختمان اسفنوئید و ساقه هیپوفیز
۶. پروتکلهای پیشرفته و توالیهای اختصاصی
- Diffusion-Weighted Imaging (DWI): برای شناسایی تغییرات سلولی و افتراق تومور از ضایعات آبسهای یا هموراژیک
- Susceptibility-Weighted Imaging (SWI): برای شناسایی کلسیم یا خون در ضایعات پیچیده مانند کرانیوفارینگیوما
- 3D Volumetric Imaging:اندازهگیری دقیق حجم تومور و پیگیری تغییرات پس از درمان
۷. نکات عملی و توصیههای تکنیکی
- استفاده از کویلهای سر چندکاناله برای افزایش نسبت سیگنال به نویز
- کاهش ضخامت برشها تا حد امکان بدون افت کیفیت
- تنظیم فیلد دید (FOV) برای پوشش کامل هیپوفیز و ساختارهای اطراف
- ثبت تصاویر قبل و بعد از تزریق کنتراست برای تحلیل دینامیک
۸. ارتباط پروتکل MRI با تشخیص و مدیریت بالینی
اجرای پروتکلهای استاندارد باعث:
- تشخیص زودهنگام میکروآدنومها و کاهش عوارض اندوکرینی
- تمایز تومورهای پیچیده و افتراق از کیستها و ضایعات نادر
- برنامهریزی جراحی دقیق و پیشبینی ریسک فشار بر ساختارهای حیاتی
- پیگیری تغییرات پس از درمان دارویی یا جراحی
۹. Case Study مرتبط
در مورد Unusual Double Pituitary Adenoma، استفاده از پروتکل DCE-MRI و برشهای نازک کرونال و ساژیتال توانست دو تومور جداگانه با ویژگیهای رادیولوژیک متفاوت را شناسایی کند. این مثال نشان میدهد که رعایت پروتکل دقیق MRI میتواند مسیر تصمیمگیری جراحی و درمان دارویی را بهینه کند.
یافتههای مورفولوژیک تومور هیپوفیز در MRI
اهمیت بررسی مورفولوژیک
یافتههای مورفولوژیک در MRI نقش کلیدی در تشخیص، طبقهبندی و برنامهریزی درمان تومورهای هیپوفیز دارند. ویژگیهایی مانند اندازه، شکل، مرزها و ترکیب بافتی تومور به پزشک کمک میکند تا نوع تومور، رفتار بالینی و احتمال عوارض را پیشبینی کند.
۱. اندازه و حجم تومور
- میکروآدنومها: قطر کمتر از ۱۰ میلیمتر و حجم کوچک، اغلب با اثر فشار کم یا بدون اثر بالینی.
- ماکروآدنومها: قطر بیش از ۱۰ میلیمتر و گاهی با گسترش سوپراسِلار، که در MRI به صورت ضایعات بزرگ و گاهی هتروژن با مرزهای واضح یا نسبی دیده میشوند.
- تومورهای غولپیکر و تهاجمی: حجم بزرگ و گسترش وسیع به سینوس غاری، ساقه هیپوفیز یا مناطق اطراف مغز که نیاز به ارزیابی دقیق برای جراحی دارد.
۲. شکل و مرزهای تومور
- مرزهای مشخص: اغلب در آدنومهای خوشخیم دیده میشود و به جراح اجازه برنامهریزی دقیق میدهد.
- مرزهای نامشخص یا نفوذی: در تومورهای تهاجمی یا غیرترشحی، مرزها ممکن است با بافت اطراف مخلوط شوند و تشخیص افتراقی پیچیده شود.
- شکل تومور (بیضوی، گرد یا نامنظم) میتواند با نوع تومور و الگوی گسترش آن مرتبط باشد.
۳. ترکیب بافتی و سیگنال MRI
- هموژن یا هتروژن: آدنومهای ترشحی اغلب هموژن هستند، در حالی که کرانیوفارینگیوما و آدنومهای با بخشهای کیستیک یا خونریزیدهنده هتروژن دیده میشوند.
- سیگنال T1 و T2:
- :T1 آدنوم معمولاً هیپواینتنس نسبت به بافت هیپوفیز طبیعی دارد.
- :T2 بخشهای کیستیک یا مایع روشن دیده میشوند.
- همچنین، وجود مناطق خونریزی یا کلسیفیکاسیون میتواند ویژگی تومورهای نادر مانند کرانیوفارینگیوما را نشان دهد.
۴. گسترش تومور و فشار بر ساختارهای اطراف
- بررسی فشار بر ساقه هیپوفیز برای پیشبینی اختلال هورمونی.
- بررسی فشار بر عصب بینایی و chiasm برای پیشبینی اختلالات بینایی.
- گسترش سوپراسِلار یا نفوذ به سینوس غاری در ماکروآدنومها و تومورهای غولپیکر که اهمیت جراحی را افزایش میدهد.
۵. ویژگیهای خاص MRI برای انواع تومورهای هیپوفیز
- آدنومهای ترشحی: الگوی دیرهنگام enhancement در DCE-MRI، به خصوص در میکروآدنومهای ACTH یا GH ترشحکننده.
- آدنومهای غیرترشحی: معمولاً بدون الگوی دینامیک مشخص، با مرزهای واضح یا نسبی.
- کرانیوفارینگیوما: ترکیب بخشهای کیستیک و کلسیفیکاسیون، هایپراینتنس T2، هتروژن
- کیستهای Rathke: توالی T1 و T2 با سیگنال مایع روشن، معمولاً enhancement محدودی دارند.
۶. کاربرد MRI در تشخیص اختلالات ترکیبی و تومورهای نادر
- در مورد Unusual Double Pituitary Adenoma، MRI توانست دو آدنوم متفاوت را با اندازه، مرز و سیگنال MRI مجزا شناسایی کند.
- این یافتهها نشان میدهد که بررسی مورفولوژیک دقیق در MRI برای افتراق تومورهای ترکیبی، تصمیمگیری جراحی و برنامهریزی درمان دارویی حیاتی است.
۷. ارتباط با بالین و برنامهریزی درمان
- تعیین دقیق حجم و مرزها برای جراحی آدنومهای ماکرو و میکرو بسیار مهم است.
- پیشبینی فشار بر ساختارهای حیاتی برای مدیریت اختلالات بینایی و هورمونی.
- پیگیری پس از درمان دارویی یا جراحی با MRI مورفولوژیک، امکان ارزیابی پاسخ و تشخیص عود تومور را فراهم میکند.
۸. جمعبندی یافتههای مورفولوژیک
یافتههای مورفولوژیک در MRI شامل اندازه، شکل، مرز، ترکیب بافتی، گسترش و اثر بر ساختارهای اطراف هستند. این دادهها نقش کلیدی در تصمیمگیری بالینی دارند و باعث افزایش دقت تشخیص، کاهش عوارض و بهبود نتایج درمانی میشوند.
نقش تزریق ماده حاجب و الگوهای Enhancement در MRI تومور هیپوفیز
اهمیت استفاده از ماده حاجب در MRI هیپوفیز
تزریق ماده حاجب، به ویژه گادولینیوم، یک ابزار کلیدی در تصویربرداری MRI هیپوفیز است که دقت تشخیص تومورهای هیپوفیز، به خصوص میکروآدنومها، را به طور قابل توجهی افزایش میدهد. استفاده از Enhancement میتواند الگوهای متفاوتی را در انواع تومورها نشان دهد و نقش حیاتی در برنامهریزی درمان جراحی و دارویی دارد.
۱. اصول فیزیولوژیک Enhancement
- ماده حاجب با جریان خون وارد بافتها میشود و در MRI باعث افزایش سیگنال در T1-Weighted Imaging میشود.
- بافتهای نرمال هیپوفیز دارای خونرسانی غنی هستند و سریع Enhancement میشوند، در حالی که آدنومهای ترشحی اغلب دیرتر enhancement میشوند.
- این تفاوت زمانی، پایه تشخیص دینامیک تومورهای کوچک و میکروآدنومها را تشکیل میدهد.
۲.Dynamic Contrast-Enhanced MRI (DCE-MRI)
- توالیهای داینامیک پس از تزریق گادولینیوم برای شناسایی میکروآدنومها بسیار موثر هستند.
- در DCE-MRI، تصاویر سریالی در بازههای زمانی کوتاه ثبت میشوند تا الگوی افزایش سیگنال تومور نسبت به بافت نرمال هیپوفیز مشاهده شود.
- مزایا:
- تشخیص دقیق میکروآدنومها
- افتراق آدنومهای ترشحی و غیرترشحی
- تعیین مرزهای دقیق تومور برای جراحی
۳. الگوهای Enhancement در انواع تومورها
- آدنومهای ترشحی: غالباً الگوی دیرهنگام و کمتری نسبت به بافت نرمال دارند؛ این ویژگی در DCE-MRI به تشخیص آنها کمک میکند.
- آدنومهای غیرترشحی: معمولاً enhancement مشابه بافت اطراف دارند، اما در ماکروآدنومها مرزهای واضحی ایجاد میشود.
- کرانیوفارینگیوما: بخشهای کیستیک معمولاً enhancement محدودی دارند، در حالی که بخشهای جامد هتروژن enhancement نشان میدهند.
- کیستهای Rathke :معمولاً enhancement محدودی دارند و بخشهای مایع روشن در T2 مشخص میشوند.
۴. نحوه انجام MRI با ماده حاجب
- تزریق وریدی گادولینیوم با دوز استاندارد (0.1 میلیمول بر کیلوگرم وزن بدن)
- ثبت تصاویر سریالی در بازه زمانی چند ثانیه تا چند دقیقه پس از تزریق
- ترکیب توالیهای کرونال و ساژیتال برای بررسی دقیق مرزها و فشار بر ساختارهای اطراف
۵. ارتباط Enhancement با تشخیص افتراقی
- در برخی موارد، تومورهای غیرترشحی یا ترکیبی ممکن است مشابه بافت نرمال باشند، اما الگوی enhancement غیرطبیعی به افتراق آنها کمک میکند.
- استفاده از DCE-MRI و مقایسه سیگنال قبل و بعد از تزریق ماده حاجب باعث افزایش حساسیت و specificity تشخیص میشود.
۶. کاربرد در مدیریت بالینی
- تعیین اندازه دقیق و مرز تومور برای جراحی کم تهاجمی
- پیشبینی فشار بر ساقه هیپوفیز و عصب بینایی
- پیگیری پاسخ به درمان دارویی ) مثل داروهای سرکوبکننده پرولاکتین یا (GH
- شناسایی عود تومور پس از جراحی یا درمان رادیوتراپی
۷. Case Study مرتبط
در مورد Sellar Glomus Tumor Misdiagnosed as Pituitary Adenoma، MRI با تزریق گادولینیوم نقش مهمی در افتراق تومور glomus از آدنوم هیپوفیز داشت. الگوی غیرطبیعی enhancement باعث شد پزشکان پیش از جراحی تصمیمگیری دقیقتری داشته باشند و اشتباه تشخیصی کاهش یابد.
۸. توصیههای عملی برای تصویربرداری با ماده حاجب
- استفاده از توالیهای نازک با برش ۲–۳ میلیمتر برای بهینهسازی spatial resolution
- ثبت تصاویر دینامیک در چند مرحله زمانی برای تحلیل دقیق
- ارزیابی گسترش سوپراسِلار، فشار بر عصب بینایی و ارتباط با سینوس غاری
- ترکیب با توالی T2 برای ارزیابی بخشهای کیستیک و افتراق از بافت نرمال
۹. جمعبندی نقش Enhancement
استفاده از ماده حاجب و تحلیل الگوهای Enhancement باعث افزایش دقت تشخیص MRI هیپوفیز میشود. این ابزار به افتراق میکروآدنومها، شناسایی تومورهای نادر و پیچیده و برنامهریزی جراحی و درمان دارویی کمک میکند. به طور کلی، Enhancement جزء ضروری پروتکل استاندارد MRI هیپوفیز است و بدون آن، تشخیص بسیاری از تومورهای کوچک و نادر دشوار میشود.
تشخیص افتراقی ضایعات هیپوفیز در MRI
اهمیت تشخیص افتراقی
تشخیص دقیق نوع ضایعات هیپوفیز در MRI برای تصمیمگیری بالینی و برنامهریزی درمانی حیاتی است. بسیاری از تومورها و کیستها میتوانند مشابه آدنومهای هیپوفیز ظاهر شوند، اما رفتار بالینی، نیازهای جراحی و پیشآگهی متفاوتی دارند. تشخیص افتراقی دقیق باعث کاهش خطاهای درمانی و پیشبینی بهتر عوارض میشود.
۱. آدنومهای هیپوفیز در مقابل کیستهای Rathke
- آدنومها: معمولاً جامد، هموژن یا هتروژن با enhancement متفاوت پس از تزریق ماده حاجب.
- کیستهای Rathke: اغلب حاوی مایع، signal روشن در T2 و enhancement محدود.
- نکته تشخیصی: بخش جامد در کیستهای Rathke نادر است، بنابراین بررسی بخشهای جامد و enhancement در MRI برای افتراق ضروری است.
۲. آدنومها در مقابل کرانیوفارینگیوما
- آدنومها: معمولاً در مرکز هیپوفیز واقع شده و مرزهای مشخص دارند.
- کرانیوفارینگیوما: بخشهای کیستیک، کلسیفیکاسیون و گاهی هتروژن enhancement دارند و اغلب سوپراسِلار گسترش مییابند.
- MRI کاربردی T1، T2 و SWI: برای شناسایی بخشهای کلسیفیکه و مایع ضروری است.
۳. آدنومها در مقابل ضایعات خلفی هیپوفیز
- Pituicytoma و Glioma: در بخش خلفی یا ساقه هیپوفیز ظاهر میشوند، هموژن و enhancement محدود دارند.
- افتراق از آدنومهای خلفی: آدنومها معمولاً در بخش قدامی هیپوفیز هستند و الگوی enhancement دینامیک دارند.
۴. آدنومهای ترشحی در مقابل غیرترشحی
- آدنوم ترشحی: دیرهنگام enhancement در DCE-MRI و علائم بالینی مشخص (مثل سندرم کوشینگ یا هایپرپرولاکتینمی).
- آدنوم غیرترشحی: غالباً هموژن، enhancement مشابه بافت طبیعی و علائم بالینی کمتر مشخص.
- نکته کاربردی: ترکیب یافته MRI و آزمایشهای هورمونی باعث تشخیص دقیق میشود.
۵. افتراق ضایعات نادر و ترکیبی
- Unusual Double Pituitary Adenoma :دو آدنوم با ویژگیهای MRI متفاوت. برای تشخیص، باید توالیهای دینامیک و برشهای نازک استفاده شود.
- Sellar Glomus Tumor :در MRI شبیه آدنوم دیده میشود، اما الگوی enhancement غیرطبیعی و موقعیت دقیق تومور باعث افتراق میشود.
- Abscess Formation in Pituitary Adenoma:تغییرات سیگنال در T1 و T2 و بخشهای غیرهموژن پس از تزریق گادولینیوم نشاندهنده پیشرفت آبسه است.
۶. معیارهای کلیدی در تشخیص افتراقی
- اندازه و مرزها: مرزهای مشخص یا نفوذی، اندازه تومور
- الگوی Enhancement: دیرهنگام، هموژن یا هتروژن
- نوع سیگنالT1/T2: هیپو، ایزو یا هایپراینتنس
- گسترش به ساختارهای اطراف: فشار بر ساقه هیپوفیز، عصب بینایی، سینوس غاری
- الگوی بالینی و هورمونی: اطلاعات آزمایشگاهی برای آدنومهای ترشحی
۷. کاربرد MRI پیشرفته در افتراق ضایعات
- DCE-MRI :شناسایی میکروآدنومها و افتراق آنها از بافت طبیعی
- SWI و DWI: شناسایی خونریزی یا کلسیفیکاسیون
- 3D Volumetric Imaging: اندازهگیری دقیق حجم و مرزها برای جراحی یا پیگیری
۸. اهمیت افتراق در مدیریت بالینی
- تصمیمگیری جراحی کم تهاجمی برای ماکروآدنومها و تومورهای پیچیده
- برنامهریزی درمان دارویی برای آدنومهای ترشحی
- پیشبینی اختلالات بینایی و هورمونی
- ارزیابی ریسک عود یا پیشرفت تومور
کاربرد توالیهای پیشرفته MRI در تشخیص تومور هیپوفیز
اهمیت توالیهای پیشرفته
با وجود قدرت MRI استاندارد در تشخیص بسیاری از تومورهای هیپوفیز، برخی ضایعات کوچک، ترکیبی یا نادر ممکن است با تکنیکهای کلاسیک به سختی شناسایی شوند. توالیهای پیشرفته MRI، شامل DCE-MRI، DWI، SWI و 3D volumetric imaging، امکان ارزیابی دقیق مورفولوژی، فعالیت سلولی و ارتباط با ساختارهای اطراف را فراهم میکنند. این توالیها برای تصمیمگیری بالینی و برنامهریزی جراحی بسیار حیاتی هستند.
۱. Dynamic Contrast-Enhanced MRI (DCE-MRI)
- ثبت تصاویر سریالی قبل و بعد از تزریق گادولینیوم با فواصل زمانی کوتاه
- کمک به شناسایی میکروآدنومها و افتراق آنها از بافت هیپوفیز طبیعی
- الگوی دیرهنگام enhancement در آدنومهای ترشحی (مثل ACTH یا GH) باعث افتراق آنها از آدنومهای غیرترشحی میشود
- کاربرد در برنامهریزی جراحی و تعیین مرزهای دقیق تومور
۲.Diffusion-Weighted Imaging (DWI)
- ارزیابی انتشار مولکولهای آب در بافت تومور
- کاربرد اصلی در افتراق تومورهای جامد از ضایعات آبسهای
- در Abscess Formation in Pituitary Adenoma، DWI کمک میکند تا تغییرات سلولی و تجمع مایع تشخیص داده شود
- افزایش حساسیت برای شناسایی بافتهای سلولی متراکم و بررسی پاسخ به درمان
۳. Susceptibility-Weighted Imaging (SWI)
- شناسایی کلسیفیکاسیون و خونریزی در تومور
- بسیار مفید در تشخیص کرانیوفارینگیوما و تومورهای ترکیبی که بخشهای کلسیفیه دارند
- کمک به افتراق از آدنومهای ساده و کیستهای Rathke
۴. 3D Volumetric Imaging
- تصاویر حجمی با رزولوشن بالا که امکان اندازهگیری دقیق حجم و مرزهای تومور را فراهم میکنند
- ارزیابی گسترش سوپراسِلار و فشار بر عصب بینایی یا سینوس غاری
- کاربرد در پیگیری پاسخ به درمان دارویی یا جراحی و شناسایی عود تومور
۵. MRI Functional و تکنیکهای تکمیلی
- MR Angiography (MRA): بررسی عروق اطراف تومور و ارزیابی نزدیکی به شریان کاروتید داخلی
- MR Spectroscopy (MRS): بررسی متابولیسم سلولی تومور و افتراق آدنوم از سایر ضایعات
- این تکنیکها برای تومورهای پیچیده و rare tumors مانند Sellar Glomus Tumor یا Double Pituitary Adenoma کاربردی هستند
۶. اهمیت ترکیب توالیها
- ترکیب توالیهای پیشرفته با T1 و T2 استاندارد باعث افزایش دقت تشخیص و کاهش اشتباهات افتراقی میشود
- مثال: ترکیب DCE-MRI و SWI در شناسایی آدنومهای خونریزیدهنده و تومورهای با کلسیفیکاسیون
- ترکیب DWI و volumetric imaging در پیگیری پاسخ به درمان دارویی و جراحی
۷. ارتباط توالیهای پیشرفته با تصمیمگیری بالینی
- تعیین مرز دقیق تومور برای جراحی کم تهاجمی
- افتراق میکروآدنومها از بافت طبیعی برای درمان دارویی هدفمند
- پیشبینی فشار بر ساختارهای حیاتی و احتمال اختلالات بینایی و هورمونی
- تشخیص زودهنگام تغییرات پاتولوژیک، مثل آبسه یا هموراژ، قبل از بروز علائم بالینی
۹. جمعبندی کاربرد توالیهای پیشرفته
- توالیهای پیشرفته MRI ابزارهای حیاتی برای تشخیص تومورهای هیپوفیز هستند
- افزایش حساسیت و specificity تشخیص، افتراق ضایعات نادر، شناسایی ترکیبی یا میکروآدنومها
- بهینهسازی تصمیمگیری درمانی و کاهش عوارض جراحی
- پیگیری دقیق تغییرات پس از درمان دارویی یا جراحی
محدودیتها و چالشهای MRI در تشخیص تومورهای هیپوفیز
اهمیت بررسی محدودیتها
با وجود توانمندی بالای MRI در تشخیص تومورهای هیپوفیز، برخی محدودیتها و چالشها میتوانند دقت تشخیص را کاهش دهند. شناسایی این چالشها برای برنامهریزی دقیق درمان و جلوگیری از اشتباهات بالینی حیاتی است.
۱. محدودیتهای فنی MRI
- رزولوشن مکانی محدود: در میکروآدنومهای کمتر از ۳ میلیمتر، تشخیص دقیق ممکن است مشکل باشد.
- نویز و artifacts: حرکت بیمار، فلزات داخل بدن یا کویلهای نامناسب میتواند تصاویر را مخدوش کند.
- تراکم بافت اطراف: ساختمانهای استخوانی و سینوس اسفنوئید ممکن است بخشی از هیپوفیز را پنهان کنند و شناسایی ضایعات کوچک را دشوار کنند.
۲. چالشهای مرتبط با توالیها و ماده حاجب
- DCE-MRI و حساسیت محدود در برخی آدنومها: برخی آدنومهای ترشحی بسیار کوچک ممکن است enhancement مشخصی نداشته باشند.
- محدودیتهای SWI و DWI: این توالیها برای تومورهای نادر و تغییرات سلولی مفید هستند، اما در افتراق دقیق بخشهای کیستیک یا هتروژن، دقت ممکن است کاهش یابد.
- نارسایی تزریق ماده حاجب: مشکلات وریدی یا واکنشهای جانبی میتوانند باعث کاهش کیفیت تصاویر بعد از تزریق شوند.
۳. چالشهای تشخیص افتراقی
- تومورهای نادر یا ترکیبی: مانند Double Pituitary Adenoma یا Sellar Glomus Tumor، ممکن است مشابه آدنومهای معمولی به نظر برسند و اشتباه تشخیصی ایجاد کنند.
- اختلالات پس از درمان: اسکار جراحی، رادیوتراپی یا داروهای سرکوبکننده میتوانند سیگنال MRI را تغییر دهند و تشخیص عود را پیچیده کنند.
- اختلالات هورمونی بدون ضایعه واضح: برخی اختلالات ترشحی ممکن است بدون تغییر مورفولوژیک مشخص در MRI ظاهر شوند، مانند میکروآدنومهای ACTH کوچک.
۴. محدودیتهای مرتبط با بیمار و محیط تصویربرداری
- بیماران با حرکت غیرقابل کنترل، اضطراب یا ناراحتی میتوانند تصاویر با کیفیت پایین تولید کنند.
- محدودیتهای تجهیزات MRI در مراکز با فناوری قدیمی یا کویلهای تک کاناله.
- وزن بالا یا شرایط فیزیکی خاص میتواند محدودیت میدان دید (FOV) ایجاد کند.
۵. چالشهای مرتبط با تفسیر تصاویر
- تجربه رادیولوژیست: افتراق ضایعات پیچیده و نادر نیازمند تجربه و مهارت بالا است.
- اختلاف بین نواحی آناتومیک: تغییرات طبیعی هیپوفیز با سن و جنس ممکن است با ضایعات اشتباه گرفته شود.
- ارتباط تصاویر با بالین: بدون ترکیب یافتههای MRI با علائم بالینی و آزمایشهای هورمونی، تشخیص دقیق دشوار است.
۶. استراتژیهای کاهش محدودیتها
- استفاده از توالیهای پیشرفته و ترکیبی DCE-MRI)، DWI، SWI، (3D volumetric
- رعایت پروتکلهای استاندارد تصویربرداری با برشهای نازک و رزولوشن بالا
آموزش و تجربه رادیولوژیستها در تفسیر ضایعات نادر و ترکیبی
- ترکیب یافتههای MRI با دادههای بالینی و آزمایشهای هورمونی برای تصمیمگیری دقیق
- استفاده از MRI follow-up برای پیگیری تغییرات و شناسایی عود یا پیشرفت ضایعات
بیشتر بخوانید: آیا جراحی آندوسکوپی بهترین روش درمان تومور هیپوفیز است؟
نتیجهگیری و جمعبندی نقش MRI در تشخیص تومور هیپوفیز
MRI به عنوان ابزار اصلی در تشخیص، طبقهبندی و مدیریت تومورهای هیپوفیز نقش محوری دارد. این تکنیک غیرتهاجمی، با رزولوشن بالا و قابلیت توالیهای پیشرفته، امکان شناسایی میکروآدنومها، ماکروآدنومها و تومورهای نادر یا ترکیبی را فراهم میکند. یافتههای مورفولوژیک شامل اندازه، شکل، مرزها، سیگنال T1/T2، الگوی enhancement و گسترش به ساختارهای اطراف، پایه تصمیمگیری بالینی و برنامهریزی درمانی هستند.
استفاده از تزریق ماده حاجب و تحلیل الگوهای Enhancement دقت تشخیص میکروآدنومها و تومورهای پیچیده را افزایش میدهد و افتراق آنها از بافت طبیعی هیپوفیز را ممکن میسازد. توالیهای پیشرفته MRI، شامل DCE-MRI، DWI، SWI و 3D volumetric imaging، امکان بررسی دقیق بافت، گسترش تومور و فشار بر ساختارهای حیاتی را فراهم میکنند. این قابلیتها نه تنها در تشخیص اولیه بلکه در پیگیری پاسخ به درمان دارویی یا جراحی و شناسایی عود یا پیشرفت تومور اهمیت دارند.
با این حال، محدودیتها و چالشهای MRI نیز باید مدنظر قرار گیرند. رزولوشن محدود برای میکروآدنومهای بسیار کوچک، artifacts ناشی از حرکت بیمار یا فلزات، و دشواری در افتراق ضایعات نادر یا ترکیبی، میتوانند دقت تشخیص را کاهش دهند. مدیریت این محدودیتها با ترکیب توالیهای پیشرفته، پیگیری دینامیک، مقایسه با دادههای بالینی و هورمونی و تفسیر توسط رادیولوژیستهای مجرب، موجب بهبود نتایج بالینی میشود.
در نهایت، MRI نه تنها ابزار تشخیصی است بلکه نقش کلیدی در تصمیمگیری درمانی دارد. این تکنیک به جراحان و متخصصان غدد اجازه میدهد مرزهای تومور را شناسایی کنند، برنامه درمانی مناسب انتخاب کنند و ریسک عوارض جراحی را کاهش دهند. همچنین، MRI امکان پیگیری تغییرات پاتولوژیک و ارزیابی اثر درمان دارویی را فراهم میکند، که در بهبود کیفیت زندگی بیماران و پیشگیری از عوارض بلندمدت اهمیت دارد.
جمعبندی کلی: MRI با ارائه اطلاعات دقیق مورفولوژیک، functional و داینامیک، ابزار اصلی در تشخیص و مدیریت تومورهای هیپوفیز است و استفاده هوشمندانه از توالیهای پیشرفته و ماده حاجب، تصمیمگیری بالینی را بهینه میسازد.
منابع
- Alessandrini F., et al. — Pituitary MRI Standard and Advanced Sequences: Role in the Diagnosis and Characterization of Pituitary Adenomas
- Nagata Y., et al. — Dynamic MRI with Slow Injection of Contrast Material for the Diagnosis of Pituitary Adenoma
- Craciunas et al. — Consistency of Pituitary Adenoma: Prediction by Pharmacokinetic Dynamic Contrast‑Enhanced MRI and Comparison with Histologic Collagen Content
- Nketiah & Alcock — Up‑to‑Date Magnetic Resonance Imaging Findings for the Diagnosis of Hypothalamic and Pituitary Tumors
- Nawas et al. — A Current Perspective of Pituitary Adenoma MRI Characteristics
- McClelland et al. — Modern Imaging of Pituitary Adenomas
- Zheng B., et al. — The Current State of MRI‑Based Radiomics in Pituitary Adenoma: Promising but Challenging